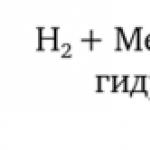Tuzlar suda neden çözünür? Tuzların oda sıcaklığında suda çözünürlüğü.Çift tuzların hazırlanması.
Su, gezegenimizdeki ana kimyasal bileşiklerden biridir. En ilginç özelliklerinden biri sulu çözeltiler oluşturabilmesidir. Bilim ve teknolojinin birçok alanında da tuzun sudaki çözünürlüğü önemli bir rol oynamaktadır.
Çözünürlük, çeşitli maddelerin sıvılarla - çözücülerle homojen (homojen) karışımlar oluşturma yeteneği olarak anlaşılmaktadır. Çözünürlüğünü belirleyen, doymuş bir çözeltiyi çözmek ve oluşturmak için kullanılan malzemenin hacmidir; bu maddenin kütle fraksiyonu veya konsantre bir çözelti içindeki miktarı ile karşılaştırılabilir.
Çözünme yeteneklerine göre tuzlar aşağıdaki gibi sınıflandırılır:
- Çözünebilir maddeler arasında 100 g suda 10 g'dan fazla çözünebilen maddeler bulunur;
- Az çözünür olanlar, solvent içindeki miktarı 1 g'ı aşmayanları içerir;
- 100 g sudaki çözünmeyen madde konsantrasyonu 0,01'den azdır.
Çözünme için kullanılan maddenin polaritesi çözücünün polaritesine benzer olduğunda çözünürdür. Farklı polaritelerde maddeyi seyreltmek büyük olasılıkla mümkün değildir.
Çözünme nasıl gerçekleşir?
Tuzun suda çözünüp çözülmediği hakkında konuşursak, çoğu tuz için bu adil bir ifadedir. Çözünürlük değerini doğru bir şekilde belirleyebileceğiniz özel bir tablo vardır. Su evrensel bir çözücü olduğundan diğer sıvılar, gazlar, asitler ve tuzlarla iyi karışır.
Bir katının suda çözünmesinin en belirgin örneklerinden biri, hemen hemen her gün mutfakta, sofra tuzu kullanılarak yemek hazırlanırken gözlemlenebilmektedir. Peki tuz neden suda çözünür?
Pek çok kişi okuldaki kimya derslerinden su ve tuz moleküllerinin kutupsal olduğunu hatırlar. Bu, elektrik kutuplarının zıt olması anlamına gelir ve bu da yüksek bir dielektrik sabitiyle sonuçlanır. Su molekülleri başka bir maddenin iyonlarını çevreler; örneğin, düşündüğümüz durumda NaCl. Bu, tutarlılığı homojen olan bir sıvı üretir.
Sıcaklığın etkisi
Tuzların çözünürlüğünü etkileyen bazı faktörler vardır. Her şeyden önce bu, çözücünün sıcaklığıdır. Ne kadar yüksek olursa, parçacıkların sıvıdaki difüzyon katsayısı da o kadar büyük olur ve kütle aktarımı daha hızlı gerçekleşir.
Örneğin, sofra tuzunun (NaCl) sudaki çözünürlüğü pratikte sıcaklığa bağlı değildir, çünkü çözünürlük katsayısı 20° C'de 35,8 ve 78° C'de 38,0'dır. Ancak bakır sülfat (CaSO4) artan sıcaklıkla birlikte suda çözünür daha az iyi.
Çözünürlüğü etkileyen diğer faktörler şunlardır:
- Çözünmüş parçacıkların boyutu – daha geniş bir faz ayrımı alanıyla çözünme daha hızlı gerçekleşir.
- Yoğun bir şekilde gerçekleştirildiğinde daha verimli kütle aktarımını destekleyen bir karıştırma işlemi.
- Safsızlıkların varlığı: Bazıları çözünme sürecini hızlandırırken diğerleri difüzyonu karmaşıklaştırarak sürecin hızını azaltır.
Tuz çözünme mekanizması hakkında video
Tuz, bir asit ile bir bazın reaksiyonu sonucu oluşan ancak su olmayan bir bileşik olarak tanımlanabilir. Bu bölümde iyonik dengeyle ilişkili tuzların özellikleri ele alınacaktır.
tuzların sudaki reaksiyonları
Çözünürlüğün göreceli bir kavram olduğu biraz sonra gösterilecektir. Bununla birlikte, önümüzdeki tartışmanın amaçları doğrultusunda, tüm tuzları kabaca suda çözünenler ve çözünmeyenler olarak ikiye ayırabiliriz.
Bazı tuzlar suda çözündüğünde nötr çözeltiler oluşturur. Diğer tuzlar asidik veya alkalin çözeltiler oluşturur. Bunun nedeni, tuz iyonları ile su arasında tersinir bir reaksiyonun ortaya çıkması ve bunun sonucunda konjuge asitlerin veya bazların oluşmasıdır. Tuz çözeltisinin nötr, asidik veya alkali olup olmadığı tuzun türüne bağlıdır. Bu anlamda dört çeşit tuz vardır.
Güçlü asitler ve zayıf bazların oluşturduğu tuzlardır. Bu tür tuzlar suda çözündüğünde asidik bir çözelti oluşturur. Örnek olarak amonyum klorür NH4Cl'yi alalım. Bu tuz suda çözündüğünde amonyum iyonu aşağıdaki gibi davranır:
Bu işlemde oluşan H3O+ iyonlarının fazlalığı çözeltinin asidik özelliğine neden olur.
Zayıf asit ve kuvvetli bazın oluşturduğu tuzlardır. Bu tür tuzlar suda çözündüğünde alkali bir çözelti oluşturur. Örnek olarak, sodyum asetat CH3COONa1'i ele alalım. Asetat iyonu, sudan bir proton kabul ederek baz görevi görür ve bu durumda asit görevi görür:
Bu işlemde oluşan OH- iyonlarının fazlalığı çözeltinin alkali özelliğini belirler.
Kuvvetli asitler ve kuvvetli bazların oluşturduğu tuzlardır. Bu tür tuzlar suda çözündüğünde nötr bir çözelti oluşur. Örnek olarak sodyum klorür NaCl'yi ele alalım. Bu tuz suda çözündüğünde tamamen iyonlaşır ve dolayısıyla Na+ iyonlarının konsantrasyonu Cl- iyonlarının konsantrasyonuna eşit olur. Ne biri ne de diğeri suyla asit-baz reaksiyonuna girmediğinden çözeltide fazla miktarda H3O+ veya OH iyonu oluşmaz. Bu nedenle çözümün nötr olduğu ortaya çıkıyor.
Zayıf asit ve zayıf bazların oluşturduğu tuzlardır. Bu tür tuzun bir örneği amonyum asetattır. Suda çözündüğünde amonyum iyonu suyla asit olarak reaksiyona girer ve asetat iyonu su ile baz olarak reaksiyona girer. Bu reaksiyonların her ikisi de yukarıda açıklanmıştır. Zayıf bir asit ve zayıf bir bazın oluşturduğu bir tuzun sulu çözeltisi, tuzun katyonlarının reaksiyonları sonucu oluşan H3O+ ve OH- iyonlarının bağıl konsantrasyonlarına bağlı olarak zayıf asidik, zayıf alkali veya nötr olabilir. su ile anyonlar. Bu, katyonun ve anyonun ayrışma sabitlerinin değerleri arasındaki ilişkiye bağlıdır.
Kimyasal elementlerin çözünürlük tablosu, en ünlü inorganik asitlerin, bazların ve tuzların suda çözünürlüklerini içeren bir tablodur.
Tanım 1
Kimyadaki çözünürlük tablosu 20 °C'de çözünürlüğü gösterir, sıcaklık arttıkça çözünürlük artar.
Bir maddenin çözünürlüğü 100 g su başına 1 g'dan fazlaysa suda çözünür ve 0,1 g/100 g'dan azsa çözünmezdir. Örneğin kimyadaki çözünürlük tablosunda lityumu bularak hemen hemen tüm maddelerin çözündüğünden emin olabilirsiniz. tuzlarından çözeltiler oluşur.
İncirde. 1 ve Şek. Şekil 2, asit kalıntılarının adlarıyla birlikte kimyadaki tam çözünürlük tablosunun bir fotoğrafını göstermektedir.
Şekil 1. Kimyada foto çözünürlük tablosu 2018-2019
Şekil 2. Asitleri ve asit kalıntılarını içeren kimya tablosu
Bir tuzun adını oluşturmak için periyodik tabloyu ve çözünürlüğü kullanmanız gerekir. Asit kalıntısının adı periyodik tablodaki metalin adına eklenir, örneğin:
$\mathrm(Zn_3(PO_4)_2)$ - çinko fosfat; $\mathrm(FeSO_4)$ - demir (II) sülfat.
Metin adının bulunduğu parantez içinde, eğer birkaç tane varsa, metalin değerini belirtmelisiniz. Demir durumunda ayrıca bir tuz $\mathrm(Fe_2(SO_4)_3)$ - demir (III) sülfat vardır.
Kimyada çözünürlük tablosunu kullanarak neler öğrenebilirsiniz?
Kimyada çökeltili maddeler için çözünürlük tablosu, herhangi bir reaksiyonun meydana gelme olasılığını belirlemek için kullanılır, çünkü geri dönüşü olmayan reaksiyonun meydana gelmesi için bir çökelti veya gaz oluşumu gereklidir.
Tuzlar, asitler ve bazlar için çözünürlük tablosu, kimya bilgisine tam olarak hakim olmanın imkansız olduğu temeldir. Bazların ve tuzların çözünürlüğü sadece okul çocukları için değil aynı zamanda profesyonel insanlar için de öğrenmeye yardımcı olur. Birçok yaşam ürününün yaratılması bu bilgi olmadan yapılamaz.
Asitlerin, tuzların ve bazların sudaki çözünürlük tablosu
Tuzların ve bazların sudaki çözünürlük tablosu, kimyanın temellerine hakim olmaya yardımcı olan bir kılavuzdur. Aşağıdaki notlar aşağıdaki tabloyu anlamanıza yardımcı olacaktır.
- P – çözünür bir maddeyi belirtir;
- H – çözünmeyen madde;
- M – madde sulu ortamda az çözünür;
- RK - yalnızca güçlü organik asitlere maruz kaldığında çözünebilen bir madde;
- Çizgi, doğada böyle bir canlının bulunmadığını gösterecektir;
- NK – asitlerde veya suda çözünmez;
- ? – soru işareti, günümüzde maddenin çözünmesiyle ilgili kesin bir bilginin bulunmadığını belirtir.

Tablo genellikle kimyagerler ve okul çocukları tarafından laboratuvar araştırmaları yapmak için kullanılır ve bu sırada belirli reaksiyonların ortaya çıkması için koşulların oluşturulması gerekir. Tabloyu kullanarak bir maddenin tuz veya asidik ortamda nasıl davranacağını ve çökeltinin görünüp görünmeyeceğini belirlemek mümkündür. Araştırma ve deneyler sırasında oluşan çökelti, reaksiyonun geri döndürülemezliğini gösterir. Bu, tüm laboratuvar çalışmalarının seyrini etkileyebilecek önemli bir noktadır.
| Katyonlar | Anyonlar | |||||||||
| F- | Cl- | Kardeşim... | BEN - | S 2- | NUMARA 3 - | C03 2- | SiO3 2- | SO 4 2- | PO 4 3- | |
| Na+ | R | R | R | R | R | R | R | R | R | R |
| K+ | R | R | R | R | R | R | R | R | R | R |
| NH4+ | R | R | R | R | R | R | R | R | R | R |
| Mg 2+ | RK | R | R | R | M | R | N | RK | R | RK |
| Ca2+ | NK | R | R | R | M | R | N | RK | M | RK |
| Sr 2+ | NK | R | R | R | R | R | N | RK | RK | RK |
| Ba 2+ | RK | R | R | R | R | R | N | RK | NK | RK |
| sn 2+ | R | R | R | M | RK | R | N | N | R | N |
| Pb2+ | N | M | M | M | RK | R | N | N | N | N |
| Al 3+ | M | R | R | R | G | R | G | NK | R | RK |
| Kr3+ | R | R | R | R | G | R | G | N | R | RK |
| Min 2+ | R | R | R | R | N | R | N | N | R | N |
| Fe 2+ | M | R | R | R | N | R | N | N | R | N |
| Fe 3+ | R | R | R | - | - | R | G | N | R | RK |
| Co2+ | M | R | R | R | N | R | N | N | R | N |
| Hayır 2+ | M | R | R | R | RK | R | N | N | R | N |
| Cu 2+ | M | R | R | - | N | R | G | N | R | N |
| Zn2+ | M | R | R | R | RK | R | N | N | R | N |
| Cd2+ | R | R | R | R | RK | R | N | N | R | N |
| Hg2+ | R | R | M | NK | NK | R | N | N | R | N |
| Hg 2 2+ | R | NK | NK | NK | RK | R | N | N | M | N |
| Ag+ | R | NK | NK | NK | NK | R | N | N | M | N |
Efsane:
P - madde suda oldukça çözünür; M - az çözünür; H - pratik olarak suda çözünmez, ancak zayıf veya seyreltik asitlerde kolayca çözünür; RK - suda çözünmez ve yalnızca güçlü inorganik asitlerde çözünür; NK - suda veya asitlerde çözünmez; G - çözündüğünde tamamen hidrolize olur ve suyla temas halinde bulunmaz. Çizgi, böyle bir maddenin hiç var olmadığı anlamına gelir.
Sulu çözeltilerde tuzlar tamamen veya kısmen iyonlara ayrışır. Zayıf asitlerin ve/veya zayıf bazların tuzları hidrolize uğrar. Tuzların sulu çözeltileri, hidratlı iyonlar, iyon çiftleri ve hidroliz ürünleri vb. dahil olmak üzere daha karmaşık kimyasal formlar içerir. Bazı tuzlar ayrıca alkoller, aseton, asit amidler ve diğer organik çözücüler içinde de çözünür.
Sulu çözeltilerden tuzlar, kristal hidratlar biçiminde, sulu olmayan çözeltilerden kristal solvatlar biçiminde, örneğin CaBr2 3C2 H5OH biçiminde kristalleşebilir.
Su-tuz sistemlerinde meydana gelen çeşitli işlemlere, sıcaklık, basınç ve konsantrasyona bağlı olarak tuzların ortak varlığında çözünürlüğüne, katı ve sıvı fazların bileşimine ilişkin veriler, su-tuz sistemlerinin çözünürlük diyagramları incelenerek elde edilebilir.
Tuzların sentezi için genel yöntemler.
1. Orta tuzların elde edilmesi:
1) metal ve metal olmayan: 2Na + Cl2 = 2NaCl
2) asitli metal: Zn + 2HCl = ZnCl2 + H2
3) daha az aktif bir metal Fe + CuS04 = FeS04 + Cu'nun tuz çözeltisine sahip metal
4) asidik oksitli bazik oksit: MgO + CO2 = MgCO3
5) asit CuO + H2S04 = CuS04 + H2O ile bazik oksit
6) asit oksit Ba(OH)2 + C02 = BaCO3 + H2O içeren bazlar
7) asitli bazlar: Ca(OH)2 + 2HCl = CaCl2 + 2H2O
8) asitli tuzlar: MgCO3 + 2HCl = MgCl2 + H2O + C02
BaCl2 + H2S04 = BaS04 + 2HCl
9) tuz çözeltisi ile baz çözeltisi: Ba(OH)2 + Na2S04 = 2NaOH + BaS04
10) iki tuzun çözeltileri 3CaCl2 + 2Na3PO4 = Ca3 (PO4)2 + 6NaCl
2.Asit tuzlarının elde edilmesi:
1. Bir asidin baz eksikliği ile etkileşimi. KOH + H2SO4 = KHSO4 + H2O
2. Bazın aşırı asit oksitle etkileşimi
Ca(OH)2 + 2C02 = Ca(HCO3)2
3. Ortalama tuzun asit Ca3 (PO4)2 + 4H3PO4 = 3Ca(H2PO4)2 ile etkileşimi
3.Temel tuzların elde edilmesi:
1. Zayıf bir baz ve kuvvetli bir asitin oluşturduğu tuzların hidrolizi
ZnCl2 + H2O = Cl + HCl
2. Orta metal tuzları AlCl3 + 2NaOH = Cl + 2NaCl çözeltilerine küçük miktarlarda alkalilerin eklenmesi (damla damla)
3. Zayıf asit tuzlarının orta tuzlarla etkileşimi
2MgCl2 + 2Na2C03 + H20 = 2C03 + C02 + 4NaCl
4. Karmaşık tuzların elde edilmesi:
1. Tuzların ligandlarla reaksiyonları: AgCl + 2NH3 = Cl
FeCl3 + 6KCN] = K3 + 3KCl
5. Çift tuzların elde edilmesi:
1. İki tuzun ortak kristalizasyonu:
Cr2 (S04)3 + K2S04 + 24H20 = 2 + NaCl
4. Katyon veya anyonun özelliklerinden kaynaklanan redoks reaksiyonları. 2KMnO4 + 16HCl = 2MnCl2 + 2KCl + 5Cl2 + 8H2O
2. Asit tuzlarının kimyasal özellikleri:
1. Orta tuz oluşumuyla termal ayrışma
Ca(HCO3)2 = CaCO3 + C02 + H20
2. Alkali ile etkileşim. Orta tuz alıyorum.
Ba(HCO3)2 + Ba(OH)2 = 2BaCO3 + 2H2O
3. Bazik tuzların kimyasal özellikleri:
1. Termal ayrışma. 2 C03 = 2CuO + C02 + H20
2. Asitle etkileşim: orta tuz oluşumu.
Sn(OH)Cl + HCl = SnCl2 + H20
4. Kompleks tuzların kimyasal özellikleri:
1. Az çözünen bileşiklerin oluşumu nedeniyle komplekslerin imhası:
2Cl + K2S = CuS + 2KCl + 4NH3
2. Dış ve iç küreler arasında ligand değişimi.
K2 + 6H20 = Cl2 + 2KCl
5.Çift tuzların kimyasal özellikleri:
1. Alkali çözeltilerle etkileşim: KCr(SO 4) 2 + 3KOH = Cr(OH) 3 + 2K 2 SO 4
2. İndirgeme: KCr(SO 4) 2 + 2H°(Zn, dil. H 2 SO 4) = 2CrSO 4 + H 2 SO 4 + K 2 SO 4
Bir dizi tuzun (klorürler, sülfatlar, karbonatlar, boratlar Na, K, Ca, Mg) endüstriyel üretimi için hammaddeler deniz ve okyanus suyu, buharlaşması sırasında oluşan doğal tuzlu sular ve katı tuz yataklarıdır. Sedimanter tuz yatakları oluşturan mineral grubu (Na, K ve Mg'nin sülfatları ve klorürleri) için geleneksel "doğal tuzlar" adı kullanılır. En büyük potasyum tuzu yatakları Rusya (Solikamsk), Kanada ve Almanya'da, güçlü fosfat cevheri yatakları Kuzey Afrika, Rusya ve Kazakistan'da, NaNO3 ise Şili'de bulunmaktadır.
Tuzlar gıda, kimya, metalurji, cam, deri, tekstil sanayi, tarım, tıp vb. sektörlerde kullanılmaktadır.
Ana tuz türleri
1. Boratlar (oksoboratlar), borik asit tuzları: metaborik HBO2, ortoborik H3BO3 ve serbest halde izole edilmemiş poliboronik asitler. Moleküldeki bor atomlarının sayısına bağlı olarak mono-, di, tetra-, heksaboratlar vb. olarak ayrılırlar. Boratlar ayrıca onları oluşturan asitler ve 1 başına B 2 O 3 mol sayısı ile de adlandırılır. ana oksidin molü. Bu nedenle çeşitli metaboratlar, eğer B(OH)4 anyonu veya bir zincir anyonu (BO2) içeriyorsa monoboratlar olarak adlandırılabilir. n n - diboratlar - zincirli bir çift anyon içeriyorlarsa (B 2 O 3 (OH) 2) n2n- triboratlar - eğer bir halka anyonu içeriyorlarsa (B 3 O 6) 3-.
Boratların yapıları bor-oksijen gruplarını içerir - 1'den 6'ya kadar ve bazen 9 bor atomu içeren "bloklar", örneğin:
Bor atomlarının koordinasyon sayısı 3 (bor-oksijen üçgen grupları) veya 4'tür (dört yüzlü gruplar). Bor-oksijen grupları yalnızca adanın değil, aynı zamanda daha karmaşık yapıların (zincir, katmanlı ve çerçeve polimerize edilmiş yapılar) temelini oluşturur. İkincisi, hidratlı borat moleküllerindeki suyun eliminasyonu ve oksijen atomları aracılığıyla köprü bağlarının oluşması sonucu oluşur; sürece bazen polianyonların içindeki B-O bağının bölünmesi eşlik eder. Polianyonlar, bor-oksijen tetrahedra veya üçgenler, bunların dimerleri veya yabancı anyonlar gibi yan grupları ekleyebilir.
Amonyum, alkali ve +1 oksidasyon durumundaki diğer metaller çoğunlukla MBO 2, tetraboratlar M 2 B 4 O 7, pentaboratlar MB 5 O 8 ve ayrıca dekaboratlar M 4 B 10 O gibi hidratlı ve susuz metaboratlar oluşturur. 17 N H 2 O. Oksidasyon durumu + 2'deki alkali toprak ve diğer metaller genellikle hidratlı metaboratlar, triboratlar M 2 B 6 O 11 ve heksaboratlar MB 6 O 10 verir. susuz meta-, orto- ve tetraboratların yanı sıra. Oksidasyon durumu +3 olan metaller, hidratlı ve susuz MBO3 ortoboratlarla karakterize edilir.
Boratlar renksiz amorf maddeler veya kristallerdir (esas olarak düşük simetrik yapıya sahip - monoklinik veya ortorombik). Susuz boratlar için erime sıcaklıkları 500 ila 2000 °C arasında değişir; En yüksek erime noktaları alkali metaboratlar ve alkali toprak metallerin orto ve metaboratlarıdır. Çoğu borat, eriyikleri soğutulduğunda kolaylıkla cam oluşturur. Mohs ölçeğindeki hidratlı boratların sertliği 2-5, susuz - 9'a kadar.
Hidratlanmış monoboratlar ~180°C'ye kadar kristalizasyon suyunu kaybeder, poliboratlar - 300-500°C'de; OH grupları nedeniyle suyun ortadan kaldırılması , Bor atomları etrafında koordineli olarak ~750°C'ye kadar meydana gelir. Tam dehidrasyonla, çoğu durumda 500-800 ° C'de "boratın yeniden düzenlenmesi" - kristalizasyona uğrayan, (poliboratlar için) B203'ün salınmasıyla kısmi ayrışmanın eşlik ettiği amorf maddeler oluşur.
Alkali metal boratlar, amonyum ve T1(I) suda çözünür (özellikle meta- ve pentaboratlar) ve sulu çözeltilerde hidrolize olur (çözeltiler alkali reaksiyona sahiptir). Boratların çoğu asitler tarafından, bazı durumlarda ise CO2'nin etkisiyle kolayca ayrışır; ve S02; Alkali toprak boratları ve ağır metaller alkalilerin, karbonatların ve alkali metallerin hidrokarbonatlarının çözeltileri ile etkileşime girer. Susuz boratlar, hidratlı boratlara göre kimyasal olarak daha kararlıdır. Boratlar bazı alkollerle, özellikle gliserolle suda çözünebilen kompleksler oluşturur. Güçlü oksitleyici ajanların, özellikle H202'nin etkisi altında veya elektrokimyasal oksidasyon sırasında boratlar peroksoboratlara dönüştürülür. .
Başlıca Na, Mg, Ca, Fe tuzları olan yaklaşık 100 doğal borat bilinmektedir.
Hidratlanmış boratlar şu şekilde elde edilir: H3VO3'ün metal oksitler, hidroksitler veya karbonatlarla nötrleştirilmesiyle; alkali metal boratların, çoğunlukla Na'nın, diğer metallerin tuzlarıyla değişim reaksiyonları; az çözünen boratların alkali metal boratların sulu çözeltileri ile karşılıklı dönüşümünün reaksiyonu; Mineralleştirici katkı maddeleri olarak alkali metal halojenürlerin kullanıldığı hidrotermal işlemler. Susuz boratlar, B203'ün metal oksitler veya karbonatlar ile füzyonu veya sinterlenmesi veya hidratların dehidrasyonu yoluyla elde edilir; Tek kristaller, örneğin Bi 2 O 3 gibi erimiş oksitlerdeki borat çözeltilerinde büyütülür.
Boratlar şu amaçlarla kullanılır: diğer bor bileşiklerini elde etmek için; cam, sır, emaye, seramik üretiminde şarj bileşenleri olarak; yangına dayanıklı kaplamalar ve emprenyeler için; metalin rafine edilmesi, kaynaklanması ve lehimlenmesi için eritkenlerin bileşenleri olarak”; boyalar ve vernikler için pigmentler ve dolgu maddeleri olarak; boyama mordanları, korozyon inhibitörleri, elektrolit bileşenleri, fosforlar vb. olarak Boraks ve kalsiyum boratlar en yaygın olarak kullanılır.
2. Halojenürler, halojenlerin diğer elementlerle kimyasal bileşikleri. Halojenürler genellikle halojen atomlarının diğer elementlerden daha büyük elektronegatifliğe sahip olduğu bileşikleri içerir. Halojenürler He, Ne ve Ar'dan oluşmaz. Basit veya ikili EC halojenürlere N (N- çoğunlukla monohalojenürler için 1'den IF 7 ve ReF 7 için 7'ye kadar olan bir tam sayı, ancak aynı zamanda kesirli de olabilir, örneğin Bi6Cl7 için 7/6), özellikle hidrohalik asitlerin ve interhalojen bileşiklerin tuzlarını içerir (örneğin, , haloflorürler). Ayrıca karışık halojenürler, polihalojenürler, hidrohalojenürler, oksohalojenürler, oksihalojenürler, hidroksohalojenürler, tiyohalojenürler ve kompleks halojenürler de vardır. Halojenürlerdeki halojenlerin oksidasyon sayısı genellikle -1'dir.
Element-halojen bağının doğasına bağlı olarak basit halojenürler iyonik ve kovalent olarak ikiye ayrılır. Gerçekte bağlantılar, bir veya başka bir bileşenin katkısının baskın olduğu karışık bir yapıya sahiptir. Alkali ve toprak alkali metallerin halojenürleri ve diğer metallerin birçok mono ve dihalojenürleri, bağın iyonik yapısının baskın olduğu tipik tuzlardır. Bunların çoğu nispeten refrakterdir, düşük uçucudur ve suda oldukça çözünürdür; sulu çözeltilerde neredeyse tamamen iyonlara ayrışır. Nadir toprak elementlerinin trihalojenürleri de tuz özelliklerine sahiptir. İyonik halojenürlerin sudaki çözünürlüğü genellikle iyodürlerden florürlere doğru azalır. Klorürler, bromürler ve iyodürler Ag+, Cu+, Hg+ ve Pb2+ suda az çözünür.
Metal halojenürlerdeki halojen atomlarının sayısındaki bir artış veya bir metalin yükünün iyonunun yarıçapına oranı, bağın kovalent bileşeninde bir artışa, sudaki çözünürlükte bir azalmaya ve halojenürlerin termal stabilitesinde bir azalmaya yol açar , uçuculuğun artması, oksidasyonun artması, hidroliz yeteneği ve eğilimi. Bu bağımlılıklar aynı döneme ait metal halojenürler için ve aynı metalin bir dizi halojenüründe gözlenir. Termal özellikler örneği kullanılarak kolayca gözlemlenebilirler. Örneğin 4. periyot metal halojenürlerde erime ve kaynama noktaları sırasıyla KC1 için 771 ve 1430°C, CaCl2 için 772 ve 1960°C, ScCl3 için 967 ve 975°C, TiCl4 için -24.1 ve 136°C'dir. . UF 3 için erime noktası ~ 1500°C, UF 4 1036°C, UF 5 348°C, UF 6 64,0°C'dir. Bağlantı sıralarında EH N sabit ile N Bağ kovalansı genellikle florürlerden klorürlere gidildiğinde artar ve ikincisinden bromürlere ve iyodürlere gidildiğinde azalır. Yani AlF3 için süblimleşme sıcaklığı 1280°C, AlC13 180°C, kaynama noktası AlBr3 254,8°C, AlI3 407°C'dir. ZrF4, ZrCl4ZrBr4, ZrI4 serisinde süblimleşme sıcaklığı sırasıyla 906, 334, 355 ve 418°C'dir. MF saflarında N ve MC1 N M'nin bir alt grubun metali olduğu durumda, metalin atom kütlesinin artmasıyla bağın kovalansı azalır. İyonik ve kovalent bağ bileşenlerinden yaklaşık olarak eşit katkı sağlayan az sayıda metal florür ve klorür vardır.
Ortalama element-halojen bağ enerjisi, florürlerden iyodürlere geçerken ve artan N(tabloya bakınız).
İzole edilmiş veya köprü oluşturan O atomları içeren birçok metal halid (sırasıyla okso- ve oksihalojenürler), örneğin vanadyum oksotriflorür VOF3, niyobyum dioksiflorür NbO2F, tungsten diokso-iyodür WO2I2.
Kompleks halojenürler (halometalatlar), halojen atomlarının ligand olduğu karmaşık anyonlar içerir; örneğin, potasyum hekzakloroplatinat(IV) K2, sodyum heptaflorotantalat(V), Na, lityum heksafloroarsenat(V). Floro-, oksofloro- ve klorometalatlar en yüksek termal stabiliteye sahiptir. Bağların doğası gereği, NF 4 +, N 2 F 3 +, C1F 2 +, XeF + vb. katyonlara sahip iyonik bileşikler, kompleks halojenürlere benzer.
Birçok halojenür, sıvı ve gaz fazlarında köprü bağlarının oluşmasıyla birleşme ve polimerizasyonla karakterize edilir. Buna en yatkın olanlar I ve II gruplarının metal halojenürleri, AlCl3, Sb pentaflorürleri ve geçiş metalleri, MOF 4 bileşiminin oksoflorürleridir. Metal-metal bağına sahip halojenürler bilinmektedir; Cl-Hg-Hg-Cl.
Florürlerin özellikleri diğer halojenürlerden önemli ölçüde farklıdır. Bununla birlikte, basit halojenürlerde bu farklılıklar halojenlerin kendisinden daha az belirgindir ve karmaşık halojenürlerde ise basit halojenürlerden daha az belirgindir.
Birçok kovalent halojenür (özellikle florürler) güçlü Lewis asitleridir; AsF 5, SbF 5, BF 3, A1C1 3. Florürler süper asitlerin bir parçasıdır. Daha yüksek halojenürler metaller ve hidrojen ile indirgenir, örneğin:
5WF 6 + W = 6WF 5
TiCl4 + 2Mg = Ti + 2MgCl2
UF 6 + H2 = UF 4 + 2HF
Cr ve Mn hariç V-VIII gruplarının metal halojenürleri H2 ile metallere indirgenir, örneğin:
WF 6 + ZN 2 = W + 6HF
Birçok kovalent ve iyonik metal halojenür birbiriyle reaksiyona girerek karmaşık halojenürler oluşturur, örneğin:
KS1 + TaCl5 = K
Daha hafif halojenler daha ağır halojenürlerin yerini alabilir. Oksijen halojenürleri oksitleyerek C1 2, Br 2 ve I 2'yi açığa çıkarabilir. Kovalent halojenürlerin karakteristik reaksiyonlarından biri, su (hidroliz) veya ısıtıldığında buharı (pirohidroliz) ile etkileşime girerek oksitlerin, oksi- veya oksohalojenürlerin, hidroksitlerin ve hidrojen halojenürlerin oluşumuna yol açmasıdır.
Halojenürler, hidrojen halojenürlerin veya hidrohalik asitlerin elementler, oksitler, hidroksitler veya tuzlarla reaksiyonunun yanı sıra değişim reaksiyonları yoluyla doğrudan elementlerden elde edilir.
Halojenürler, halojenlerin, alkali ve toprak alkali metallerin üretimi için başlangıç malzemeleri olarak, camların ve diğer inorganik malzemelerin bileşenleri olarak teknolojide yaygın olarak kullanılmaktadır; nadir ve bazı demir dışı metaller, U, Si, Ge vb. üretiminde ara ürünlerdir.
Doğada halojenürler, florürleri (örneğin, florit, kriyolit mineralleri) ve klorürleri (silvit, karnalit) içeren ayrı mineral sınıfları oluşturur. Brom ve iyot bazı minerallerde izomorfik safsızlıklar olarak bulunur. Deniz ve okyanus suyunda, tuzlarda ve yer altı tuzlu sularında önemli miktarlarda halojenür bulunur. NaCl, KC1, CaCl 2 gibi bazı halojenürler canlı organizmaların bir parçasıdır.
3. Karbonatlar (Latince karbondan, cinsiyet karbonis kömüründen), karbonik asit tuzları. CO 3 2 anyonuna sahip orta karbonatlar ve HCO 3 anyonuna sahip asidik veya hidrokarbonatlar (eski bikarbonatlar) mevcuttur. Karbonatlar kristal maddelerdir. +2 oksidasyon durumundaki çoğu orta metal tuzları altıgenler halinde kristalleşir. kafes tipi kalsit veya eşkenar dörtgen tipi aragonit.
Orta karbonatlardan yalnızca alkali metallerin, amonyumun ve Tl(I) tuzları suda çözünür. Önemli hidroliz sonucunda çözeltileri alkali reaksiyona sahiptir. Metal karbonatların oksidasyon durumu +2'de çözülmesi en zordur. Aksine, tüm bikarbonatlar suda oldukça çözünür. Metal tuzları ve Na2C03 arasındaki sulu çözeltilerdeki değişim reaksiyonları sırasında, çözünürlüklerinin karşılık gelen hidroksitlerinkinden önemli ölçüde daha az olduğu durumlarda orta karbonat çökeltileri oluşur. Bu durum Ca, Sr ve bunların analogları olan lantanitler, Ag(I), Mn(II), Pb(II) ve Cd(II) için de geçerlidir. Geriye kalan katyonlar, hidroliz sonucunda çözünmüş karbonatlarla etkileşime girdiğinde ara madde değil, bazik yengeçatlar ve hatta hidroksitler verebilir. Çoklu yüklü katyonlar içeren orta dereceli yengeçatlar bazen büyük miktarda CO2 fazlalığının mevcudiyetinde sulu çözeltilerden çökeltilebilir.
Karbonatların kimyasal özellikleri, zayıf asitlerin inorganik tuzları sınıfına ait olmalarından kaynaklanmaktadır. Karbonatların karakteristik özellikleri, zayıf çözünürlüklerinin yanı sıra hem yengeçlerin hem de H2C03'ün termal kararsızlığı ile ilişkilidir. Bu özellikler, ya güçlü asitlerle ayrışmalarına ve elde edilen CO2'nin bir alkali çözelti tarafından kantitatif olarak emilmesine ya da CO32-iyonunun çözeltiden BaCO formunda çökelmesine dayalı olarak yengeçonatların analizinde kullanılır. 3. Aşırı CO2, orta karbonat çökeltisine etki ettiğinde, çözeltide hidrojen karbonat oluşur, örneğin: CaCO3 + H2O + CO2 = Ca(HCO3)2. Doğal sularda hidrokarbonatların varlığı geçici sertliğe neden olur. Hidrokarbonatlar, düşük sıcaklıklarda bile hafifçe ısıtıldığında tekrar orta karbonatlara dönüşür ve ısıtıldığında oksit ve C02'ye ayrışır. Metal ne kadar aktif olursa, karbonatının ayrışma sıcaklığı da o kadar yüksek olur. Böylece, Na2C03 857 °C'de ayrışmadan erir ve Ca, Mg ve A1 karbonatlar için denge ayrışma basınçları sırasıyla 820, 350 ve 100 °C sıcaklıklarda 0,1 MPa'ya ulaşır.
Karbonatlar doğada çok yaygındır; bu, CO2 ve H2O'nun mineral oluşum süreçlerine katılımından kaynaklanmaktadır. karbonatlar, atmosferdeki gaz halindeki CO2 ile çözünmüş CO2 arasındaki küresel dengede büyük bir rol oynar;
ve hidrosferdeki HCO3- ve CO32- iyonları ve litosferdeki katı tuzlar. En önemli mineraller kalsit CaCO 3, manyezit MgCO 3, siderit FeCO 3, smithsonit ZnCO 3 ve diğerleridir. Kireçtaşı çoğunlukla organizmaların kalsit veya kalsit iskelet kalıntılarından, nadiren aragonitten oluşur. Alkali metallerin ve Mg'nin doğal hidratlı karbonatları (örneğin, MgCO 3 ZH 2 O, Na 2 CO 3 10H 2 O), çift karbonatlar [ örneğin dolomit CaMg(CO 3) 2, trona Na 2 C03 NaHC03 2H 2 O] ve bazik [malakit CuCO3 Cu(OH)2, hidroserussit 2PbCO3Pb(OH)2] de bilinmektedir.
En önemlileri potasyum karbonat, kalsiyum karbonat ve sodyum karbonattır. Birçok doğal karbonat çok değerli metal cevherleridir (örn. Zn, Fe, Mn, Pb, Cu karbonatlar). Bikarbonatlar, kan pH'ının sabitliğini düzenleyen tampon maddeler olarak önemli bir fizyolojik rol oynar.
4. Nitratlar, nitrik asit HNO 3 tuzları. Hemen hemen tüm metallerle tanınır; her ikisi de susuz tuzlar M(NO 3) formunda bulunur N (N- M metalinin oksidasyon durumu) ve kristal hidratlar M(NO3) formunda N X H20 ( X= 1-9). Oda sıcaklığına yakın sıcaklıklardaki sulu çözeltilerden yalnızca alkali metal nitratlar susuz olarak kristalleşir, geri kalanı kristal hidratlar şeklinde. Aynı metalin susuz ve hidratlı nitratının fizikokimyasal özellikleri büyük ölçüde farklılık gösterebilir.
D-element nitratların susuz kristalli bileşikleri renklidir. Geleneksel olarak nitratlar, ağırlıklı olarak kovalent tipte bir bağa (Be, Cr, Zn, Fe ve diğer geçiş metallerinin tuzları) ve ağırlıklı olarak iyonik tipte bir bağa (alkali ve alkalin toprak metallerinin tuzları) sahip bileşiklere ayrılabilir. İyonik nitratlar, daha yüksek termal stabilite, daha yüksek simetriye (kübik) sahip kristal yapıların baskınlığı ve IR spektrumlarında nitrat iyon bantlarının bölünmemesi ile karakterize edilir. Kovalent nitratlar organik çözücülerde daha yüksek çözünürlüğe, daha düşük termal stabiliteye sahiptir ve IR spektrumları daha karmaşıktır; Bazı kovalent nitratlar oda sıcaklığında uçucudur ve suda çözündüklerinde kısmen ayrışarak nitrojen oksitleri açığa çıkarırlar.
Tüm susuz nitratlar, NO3 - iyonunun varlığına bağlı olarak güçlü oksitleyici özellikler sergilerken, iyonik nitratlardan kovalent nitratlara geçerken oksitleyici yetenekleri artar. İkincisi 100-300°C aralığında, iyonik olanlar ise 400-600°C'de ayrışır (NaNO 3, KNO 3 ve diğerleri ısıtıldığında erir). Ürünlerin katı ve sıvı fazda ayrışması. sırasıyla nitritler, oksinitratlar ve oksitler, bazen serbest metaller (oksit kararsız olduğunda, örneğin Ag20) ve gaz fazında - NO, NO2, O2 ve N2'dir. Ayrışma ürünlerinin bileşimi metalin doğasına ve oksidasyon derecesine, ısıtma hızına, sıcaklığa, gazlı ortamın bileşimine ve diğer koşullara bağlıdır. NH4NO3 patlar ve hızlı bir şekilde ısıtıldığında patlamayla ayrışabilir, bu durumda N2, O2 ve H2O oluşur; yavaş ısıtıldığında N 2 O ve H 2 O'ya ayrışır.
Gaz fazındaki serbest NO3 - iyonu, merkezde N atomu bulunan bir eşkenar üçgenin geometrik yapısına, ONO açıları ~ 120° ve N-O bağ uzunlukları 0,121 nm'ye sahiptir. Kristal ve gaz halindeki nitratlarda NO3 iyonu esas olarak şeklini ve boyutunu korur, bu da nitratların alanını ve yapısını belirler. NO3 - iyonu bir mono-, bi-, tridentat veya köprü ligandı olarak görev yapabilir, dolayısıyla nitratlar çok çeşitli kristal yapı tipleri ile karakterize edilir.
Sterik nedeniyle yüksek oksidasyon durumlarında geçiş metalleri. Susuz nitratlar herhangi bir zorluk oluşturamazlar ve oksonitratlarla karakterize edilirler, örneğin UO 2 (NO 3) 2, NbO(NO 3) 3. Nitratlar, iç kürede NO3 iyonu ile çok sayıda çift ve kompleks tuz oluşturur. Sulu ortamda, hidrolizin bir sonucu olarak, geçiş metali katyonları, katı halde de izole edilebilen, değişken bileşime sahip hidroksonitratlar (bazik nitratlar) oluşturur.
Hidratlanmış nitratlar, kristal yapılarında metal iyonunun çoğu durumda NO3 iyonu yerine su molekülleri ile ilişkili olması bakımından susuz nitratlardan farklıdır. Bu nedenle suda susuz nitratlara göre daha iyi çözünürler, ancak organik çözücülerde daha az çözünürler; daha zayıf oksitleyici maddelerdirler ve 25-100°C aralığında kristalizasyon suyunda uyumsuz bir şekilde erirler. Hidratlı nitratlar ısıtıldığında, kural olarak susuz nitratlar oluşmaz, ancak hidroksonitratların ve ardından oksonitrat ve metal oksitlerin oluşumuyla termoliz meydana gelir.
Nitratlar kimyasal özelliklerinin çoğunda diğer inorganik tuzlara benzer. Nitratların karakteristik özellikleri, suda çok yüksek çözünürlükleri, düşük termal stabiliteleri ve organik ve inorganik bileşikleri oksitleyebilme yeteneklerinden kaynaklanmaktadır. Nitratlar azaltıldığında, indirgeyici maddenin türüne, sıcaklığına, ortamın reaksiyonuna bağlı olarak, bunlardan birinin baskın olduğu NO 2, NO, N2O, N2 veya NH3 içeren nitrojen içeren ürünlerin bir karışımı oluşur. ve diğer faktörler.
Nitrat üretimine yönelik endüstriyel yöntemler, NH3'ün HNO3 çözeltileri (NH4NO3 için) tarafından emilmesine veya nitro gazlarının (NO + NO2) alkaliler veya karbonat çözeltileri (alkali metal nitratlar için, Ca, Mg, Ba) ve ayrıca metal tuzlarının HNO3 veya alkali metal nitratlarla çeşitli değişim reaksiyonları. Laboratuvarda susuz nitratlar elde etmek için geçiş metallerinin veya bunların bileşiklerinin sıvı N204 ile reaksiyonları ve bunun organik çözücülerle karışımları veya N205 ile reaksiyonları kullanılır.
Nitratlar Na, K (sodyum ve potasyum nitrat) doğal birikintiler halinde bulunur.
Nitratlar birçok endüstride kullanılmaktadır. Amonyum nitrit (amonyum nitrat), nitrojen içeren ana gübredir; Alkali metal nitratlar ve Ca da gübre olarak kullanılır. Nitratlar, roket yakıtlarının, piroteknik bileşimlerin, kumaş boyamaya yönelik aşındırma çözümlerinin bileşenleridir; Metallerin sertleştirilmesinde, gıdaların korunmasında, ilaç olarak ve metal oksitlerin üretiminde kullanılırlar.
Nitratlar zehirlidir. Akciğer ödemine, öksürüğe, kusmaya, akut kardiyovasküler yetmezliğe vb. neden olurlar. Nitratların insanlar için öldürücü dozu 8-15 gramdır, izin verilen günlük alım miktarı 5 mg/kg'dır. Nitrat Na, K, Ca, NH3 MPC toplamı için: suda 45 mg/l", toprakta 130 mg/kg (tehlike sınıfı 3); sebze ve meyvelerde (mg/kg) - patates 250, geç beyaz lahana 500, geç havuç 250, pancar 1400, soğan 80, kabak 400, kavun 90, karpuz, üzüm, elma, armut 60. Tarımsal teknik tavsiyelere uyulmaması, aşırı gübre uygulaması tarım ürünlerindeki nitrat içeriğini keskin bir şekilde artırır, yüzey akışı tarlalar (40-5500 mg/l), yeraltı suyu.
5. Nitritler, nitröz asit HNO 2 tuzları. Alkali metallerin ve amonyumun nitritleri öncelikle kullanılır, daha az alkali toprak ve nitritler kullanılır. D-metaller, Pb ve Ag. Diğer metallerin nitritleri hakkında yalnızca parçalı bilgiler vardır.
+2 oksidasyon durumundaki metal nitritler bir, iki veya dört su molekülü ile kristal hidratlar oluşturur. Nitritler ikili ve üçlü tuzlar oluşturur; CsNO 2 AgNO 2 veya Ba(NO 2) 2 Ni(NO 2) 2 2KNO 2'nin yanı sıra karmaşık bileşikler, örneğin Na 3.
Kristal yapılar yalnızca birkaç susuz nitrit için bilinmektedir. NO2 anyonu doğrusal olmayan bir konfigürasyona sahiptir; ONO açısı 115°, H-O bağ uzunluğu 0,115 nm; M-NO2 bağının türü iyonik-kovalenttir.
Nitritler K, Na, Ba suda iyi çözünür, nitritler Ag, Hg, Cu az çözünür. Sıcaklık arttıkça nitritlerin çözünürlüğü artar. Hemen hemen tüm nitritler alkollerde, eterlerde ve düşük polar çözücülerde az çözünür.
Nitritler termal olarak kararsızdır; Yalnızca alkali metallerin nitritleri ayrışmadan erir; diğer metallerin nitritleri 25-300 °C'de ayrışır. Nitritin ayrışma mekanizması karmaşıktır ve bir dizi paralel ardışık reaksiyonu içerir. Ana gaz halindeki ayrışma ürünleri NO, NO 2, N2 ve O2, katı metal oksit veya element metaldir. Büyük miktarda gazın salınması, bazı nitritlerin, örneğin N2 ve H20'ya ayrışan NH4NO2'nin patlayıcı ayrışmasına neden olur.
Nitritlerin karakteristik özellikleri, termal kararsızlıkları ve nitrit iyonunun çevreye ve reaktiflerin doğasına bağlı olarak hem oksitleyici bir madde hem de bir indirgeyici madde olma yeteneği ile ilişkilidir. Nötr bir ortamda nitritler genellikle NO'ya indirgenir; asidik bir ortamda nitratlara oksitlenir. Oksijen ve C02, katı nitritler ve bunların sulu çözeltileri ile etkileşime girmez. Nitritler, nitrojen içeren organik maddelerin, özellikle aminler, amidler vb.nin ayrışmasını teşvik eder. Organik halojenürler RXH ile. hem nitritleri (RONO) hem de nitro bileşiklerini (RNO2) oluşturmak üzere reaksiyona girer.
Nitritlerin endüstriyel üretimi, nitro gazının (NO + NO2 karışımı) Na2C03 veya NaOH çözeltileri ile NaN02'nin sıralı kristalizasyonuyla emilmesine dayanır; Diğer metallerin nitritleri endüstride ve laboratuvarlarda metal tuzlarının NaNO2 ile değişim reaksiyonu veya bu metallerin nitratlarının indirgenmesi yoluyla elde edilir.
Nitritler azo boyaların sentezinde, kaprolaktam üretiminde, kauçuk, tekstil ve metal işleme endüstrilerinde oksitleyici ajanlar ve indirgeyici ajanlar olarak, gıda koruyucu olarak kullanılır. NaNO 2 ve KNO 2 gibi nitritler zehirlidir, baş ağrılarına, kusmaya, solunumun baskılanmasına vb. neden olur. NaNO 2 zehirlendiğinde kanda methemoglobin oluşur ve kırmızı kan hücrelerinin zarları zarar görür. Gastrointestinal sistemde doğrudan NaNO2 ve aminlerden nitrozaminler oluşturmak mümkündür.
6. Sülfatlar, sülfürik asit tuzları. SO42-anyonlu ortam sülfatları veya HSO4-anyonlu, bazik, SO42-anyonuyla birlikte OH grupları, örneğin Zn2(OH)2S04 içeren hidrosülfatlar bilinmektedir. İki farklı katyon içeren çift sülfatlar da vardır. Bunlar iki büyük sülfat grubunu içerir - şap , shenitlerin yanı sıra M 2 E (SO 4) 2 6H 2 O , burada M tek yüklü bir katyondur, E ise Mg, Zn ve diğer çift yüklü katyonlardır. Bilinen üçlü sülfat K 2 SO 4 MgSO 4 2CaSO 4 2H 2 O (polihalit minerali), çift bazik sülfatlar, örneğin alunit ve jarosit gruplarının mineralleri M 2 SO 4 Al 2 (SO 4) 3 4Al (OH 3 ve M) 2 SO 4 Fe 2 (SO 4) 3 4 Fe(OH) 3, burada M tek yüklü bir katyondur. Sülfatlar karışık tuzların parçası olabilir, örneğin 2Na 2 SO 4 Na 2 CO 3 (mineral berkeit), MgS04 KCl 3H20 (kainit) .
Sülfatlar, çoğu durumda orta ve asidik, suda oldukça çözünür, kristalli maddelerdir. Kalsiyum, stronsiyum, kurşun ve diğer bazı sülfatlar az çözünür; BaSO 4 ve RaSO 4 pratikte çözünmez. Bazik sülfatlar genellikle az çözünür veya pratik olarak çözünmez veya su ile hidrolize edilir. Sulu çözeltilerden sülfatlar, kristalin hidratlar formunda kristalleşebilir. Bazı ağır metallerin kristal hidratlarına vitriol adı verilir; bakır sülfat CuS04 5H20, demir sülfat FeS04 7H20.
Orta alkali metal sülfatlar termal olarak stabildir, asit sülfatlar ise ısıtıldığında ayrışarak pirosülfatlara dönüşür: 2KHSO4 = H2O + K2S207. Diğer metallerin orta sülfatları ve bazik sülfatlar, yeterince yüksek sıcaklıklara ısıtıldığında, kural olarak, metal oksitlerin oluşumu ve SO3 salınımı ile ayrışır.
Sülfatlar doğada yaygın olarak dağılmaktadır. Bunlar, örneğin alçı CaSO 4 H 2 O, mirabilite Na 2 SO 4 10H 2 O gibi mineraller şeklinde bulunur ve ayrıca deniz ve nehir suyunun bir parçasıdır.
H2S04'ün metaller, oksitleri ve hidroksitleri ile etkileşiminin yanı sıra uçucu asit tuzlarının sülfürik asit ile ayrışmasıyla birçok sülfat elde edilebilir.
İnorganik sülfatlar yaygın olarak kullanılmaktadır. Örneğin, amonyum sülfat bir azotlu gübredir, sodyum sülfat camda, kağıt endüstrisinde, viskon üretiminde vb. Kullanılır. Doğal sülfat mineralleri, çeşitli metallerin, yapı malzemelerinin vb. bileşiklerinin endüstriyel üretimi için hammaddelerdir.
7.sülfitler, sülfürik asit tuzları H2S03 . SO3 2- anyonlu orta sülfitler ve HSO 3 - anyonlu asidik (hidrosülfitler) vardır. . Orta sülfitler kristalli maddelerdir. Amonyum ve alkali metal sülfitler suda oldukça çözünür; çözünürlük (100 g'da g): (NH4)2S03 40,0 (13°C), K2S03 106,7 (20°C). Hidrosülfitler sulu çözeltilerde oluşur. Alkali toprak sülfitleri ve diğer bazı metaller suda pratik olarak çözünmez; MgS03'ün 100 g'da (40°C) 1 g çözünürlüğü. Bilinen kristal hidratlar (NH4)2S03H20, Na2S037H20, K2S032H20, MgS036H2O, vb.
Susuz sülfitler, kapalı kaplarda havaya erişim olmadan ısıtıldığında orantısız bir şekilde sülfürlere ve sülfatlara ayrılır, N2 akımında ısıtıldıklarında SO2 kaybederler ve havada ısıtıldıklarında kolayca sülfatlara oksitlenirler. Sulu bir ortamda SO2 ile orta sülfitler hidrosülfitler oluşturur. Sülfitler nispeten güçlü indirgeyici maddelerdir; klor, brom, H202 vb. içeren çözeltilerde sülfatlara oksitlenirler. SO2'nin salınmasıyla güçlü asitlerle (örneğin HC1) ayrışırlar.
Kristalin hidrosülfitler K, Rb, Cs, NH4 + ile bilinir, kararsızdırlar. Geri kalan hidrosülfitler yalnızca sulu çözeltilerde bulunur. NH4HSO3'ün yoğunluğu 2,03 g/cm3; sudaki çözünürlük (100 g'da g): NH4HSO3 71,8 (0 ° C), KHSO 3 49 (20 ° C).
Kristalli hidrosülfitler Na veya K ısıtıldığında veya bol miktarda kağıt hamuru çözeltisi SO2 M2S03 ile doyurulduğunda, pirosülfitler (eski - metabisülfitler) M2S205 oluşur - bilinmeyen serbest pirosülfürik asit H2S2'nin tuzları 05; kararsız kristaller; yoğunluk (g/cm3): Na2S205 1,48, K2S205 2,34; ~ 160 °C'nin üzerinde SO2 salınımıyla ayrışırlar; suda çözünme (HSO3-'e ayrışma ile), çözünürlük (100 g'da g): Na2S205 64,4, K2S205 44,7; Na2S2057H20 ve ZK2S2052H20 hidratlarını oluşturur; azaltıcı ajanlar.
Orta alkali metal sülfitler, sulu bir M2C03 (veya MOH) çözeltisinin S02 ve MSO3 ile, S02'nin sulu bir MCO3 süspansiyonundan geçirilmesiyle reaksiyona sokulması yoluyla hazırlanır; Esas olarak kontakt sülfürik asit üretiminin egzoz gazlarından elde edilen SO2'yi kullanırlar. Sülfitler kumaşların, elyafların, tahıl muhafazası için derilerin, yeşil yemlerin, yem sanayi atıklarının (NaHSO 3,
Na2S205). CaSO 3 ve Ca(HSO 3) 2, şarap yapımı ve şeker endüstrilerinde kullanılan dezenfektanlardır. NaHSO3, MgS03, NH4HSO3 - hamurlaştırma sırasında sülfit sıvısının bileşenleri; (NH4)2S03 - SO2 emici; NaHSO 3, kükürt boyalarının üretiminde bir indirgeyici madde olan endüstriyel atık gazlardan H2S'nin emicisidir. K 2 S 2 O 5 - fotoğrafçılıkta asidik fiksatiflerin bir bileşeni, bir antioksidan, bir antiseptik.
Karışımları ayırma yöntemleri
Sıvı veya gazın geçmesine izin veren ancak katı parçacıkları tutan gözenekli filtre bölümleri (FP) kullanılarak sıvı - katı parçacıklar (süspansiyonlar) ve gaz - katı parçacıklardan oluşan heterojen sistemlerin filtrasyonu ve ayrılması. Sürecin itici gücü, faz geçişinin her iki tarafındaki basınç farkıdır.
Süspansiyonları ayırırken, katı parçacıklar genellikle FP üzerinde bir ıslak tortu tabakası oluşturur; bu, gerekirse su veya başka bir sıvı ile yıkanır ve ayrıca içinden hava veya başka bir gaz üflenerek dehidre edilir. Filtrasyon sabit bir basınç farkında veya sabit bir işlem hızında gerçekleştirilir w(birim zamanda FP yüzeyinin 1 m2'sinden geçen m3 cinsinden filtrat miktarı). Sabit bir basınç farkında, süspansiyon filtreye vakum veya aşırı basınç altında ve ayrıca bir pistonlu pompa ile sağlanır; Santrifüj pompa kullanıldığında basınç farkı artar ve proses hızı düşer.
Süspansiyon konsantrasyonuna bağlı olarak çeşitli filtreleme türleri ayırt edilir. % 1'den fazla bir konsantrasyonda, bir çökelti oluşumuyla ve% 0,1'den daha az bir konsantrasyonda FP'nin gözeneklerinin tıkanmasıyla (sıvıların arıtılması) filtrasyon meydana gelir. FP üzerinde yeterince yoğun bir tortu tabakası oluşmazsa ve katı parçacıklar süzüntüye girerse, daha önce FP'ye uygulanan veya süspansiyona eklenen, ince dağılmış yardımcı malzemeleri (diyatomlu toprak, perlit) kullanarak filtreleyin. %10'dan daha düşük bir başlangıç konsantrasyonunda, süspansiyonların kısmi ayrılması ve koyulaştırılması mümkündür.
Sürekli ve periyodik filtreler vardır. İkincisi için işin ana aşamaları filtreleme, tortunun yıkanması, susuzlaştırılması ve boşaltılmasıdır. Bu durumda en yüksek verimlilik ve en düşük maliyet kriterlerine göre optimizasyon uygulanabilir. Yıkama ve susuzlaştırma yapılmazsa ve bölmenin hidrolik direnci ihmal edilebilirse, filtreleme süresi yardımcı işlemlerin süresine eşit olduğunda en yüksek verimlilik elde edilir.
Pamuk, yün, sentetik ve cam kumaşlardan yapılan esnek FP'lerin yanı sıra doğal ve sentetik elyaflardan ve esnek olmayanlardan (seramik, sermet ve köpük) yapılan dokunmamış FP'ler de uygulanabilir. Süzüntünün hareket yönleri ve yerçekimi etkisi zıt olabilir, çakışabilir veya karşılıklı olarak dik olabilir.
Filtre tasarımları çeşitlidir. En yaygın olanlardan biri, döner tamburlu vakum filtresidir. (santimetre. Süzüntünün hareket yönlerinin ve yerçekimi eyleminin zıt olduğu sürekli eylemin Şek. Dağıtım cihazı bölümü, I ve II bölgelerini bir vakum kaynağına ve III ve IV bölgelerini basınçlı hava kaynağına bağlar. Bölge I ve II'den gelen süzüntü ve yıkama sıvısı ayrı alıcılara girer. Yatay hazneli otomatik periyodik filtre presi, sonsuz bant şeklindeki filtre kumaşı ve çamurun preslenerek susuzlaştırılması için elastik membranlar da yaygınlaştı. Odaların süspansiyonla doldurulması, filtrelenmesi, yıkanması ve susuzlaştırılması, bitişik odaların bağlantısının kesilmesi ve tortunun giderilmesi gibi alternatif işlemleri gerçekleştirir.