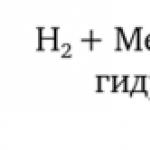ทำไมเกลือจึงละลายในน้ำ? ความสามารถในการละลายของเกลือในน้ำที่อุณหภูมิห้อง การเตรียมเกลือคู่
น้ำเป็นหนึ่งในสารประกอบเคมีหลักบนโลกของเรา คุณสมบัติที่น่าสนใจที่สุดประการหนึ่งคือความสามารถในการสร้างสารละลายที่เป็นน้ำ และในหลายสาขาของวิทยาศาสตร์และเทคโนโลยี ความสามารถในการละลายของเกลือในน้ำมีบทบาทสำคัญ
ความสามารถในการละลายเป็นที่เข้าใจกันว่าเป็นความสามารถของสารต่างๆ ในการสร้างสารผสมที่เป็นเนื้อเดียวกัน (เป็นเนื้อเดียวกัน) กับของเหลว - ตัวทำละลาย เป็นปริมาตรของวัสดุที่ใช้ในการละลายและสร้างสารละลายอิ่มตัวซึ่งกำหนดความสามารถในการละลายซึ่งเทียบได้กับเศษส่วนมวลของสารนี้หรือปริมาณในสารละลายเข้มข้น
ตามความสามารถในการละลายเกลือจำแนกได้ดังนี้:
- สารที่ละลายได้ ได้แก่ สารที่สามารถละลายในน้ำ 100 กรัมมากกว่า 10 กรัม
- ละลายได้เล็กน้อย ได้แก่ ปริมาณในตัวทำละลายไม่เกิน 1 กรัม
- ความเข้มข้นของสารที่ไม่ละลายน้ำในน้ำ 100 กรัมมีค่าน้อยกว่า 0.01
เมื่อขั้วของสารที่ใช้ละลายใกล้เคียงกับขั้วของตัวทำละลาย สารนั้นก็จะละลายได้ เนื่องจากมีขั้วต่างกัน จึงมักไม่สามารถเจือจางสารได้
การละลายเกิดขึ้นได้อย่างไร?
หากเราพูดถึงว่าเกลือละลายในน้ำหรือไม่ สำหรับเกลือส่วนใหญ่ นี่เป็นคำพูดที่ยุติธรรม มีตารางพิเศษที่คุณสามารถกำหนดค่าความสามารถในการละลายได้อย่างแม่นยำ เนื่องจากน้ำเป็นตัวทำละลายสากล น้ำจึงผสมได้ดีกับของเหลว ก๊าซ กรด และเกลืออื่นๆ
หนึ่งในตัวอย่างที่ชัดเจนที่สุดของการละลายของของแข็งในน้ำสามารถสังเกตได้เกือบทุกวันในห้องครัวขณะเตรียมอาหารโดยใช้เกลือแกง แล้วทำไมเกลือถึงละลายในน้ำ?
หลายๆ คนจำได้จากหลักสูตรเคมีของโรงเรียนว่าโมเลกุลของน้ำและเกลือมีขั้ว ซึ่งหมายความว่าขั้วไฟฟ้าอยู่ตรงข้ามกัน ส่งผลให้ค่าคงที่ไดอิเล็กตริกสูง โมเลกุลของน้ำล้อมรอบไอออนของสารอื่น ตัวอย่างเช่น ในกรณีที่เรากำลังพิจารณา NaCl ทำให้ได้ของเหลวที่มีความสม่ำเสมอเป็นเนื้อเดียวกัน
ผลกระทบของอุณหภูมิ
มีปัจจัยบางประการที่มีอิทธิพลต่อความสามารถในการละลายของเกลือ ก่อนอื่น นี่คืออุณหภูมิของตัวทำละลาย ยิ่งมีค่าสัมประสิทธิ์การแพร่กระจายของอนุภาคในของเหลวมากเท่าไร และการถ่ายโอนมวลก็จะเร็วขึ้นเท่านั้น
แม้ว่าตัวอย่างเช่นความสามารถในการละลายของเกลือแกง (NaCl) ในน้ำในทางปฏิบัติไม่ได้ขึ้นอยู่กับอุณหภูมิเนื่องจากค่าสัมประสิทธิ์การละลายของมันคือ 35.8 ที่ 20° C และ 38.0 ที่ 78° C แต่คอปเปอร์ซัลเฟต (CaSO4) เมื่ออุณหภูมิเพิ่มขึ้น น้ำจะละลาย ไม่ค่อยดี
ปัจจัยอื่นๆ ที่ส่งผลต่อความสามารถในการละลาย ได้แก่:
- ขนาดของอนุภาคที่ละลาย – ด้วยพื้นที่การแยกเฟสที่มากขึ้น การละลายจะเกิดขึ้นเร็วขึ้น
- กระบวนการผสมที่เมื่อดำเนินการอย่างเข้มข้นจะส่งเสริมการถ่ายเทมวลที่มีประสิทธิภาพมากขึ้น
- การปรากฏตัวของสิ่งสกปรก: บางชนิดเร่งกระบวนการละลาย ในขณะที่บางชนิดทำให้การแพร่กระจายซับซ้อน ลดความเร็วของกระบวนการ
วิดีโอเกี่ยวกับกลไกการละลายเกลือ
เกลือสามารถกำหนดได้ว่าเป็นสารประกอบที่เกิดจากปฏิกิริยาระหว่างกรดและเบส แต่ไม่ใช่น้ำ ในส่วนนี้จะพิจารณาคุณสมบัติของเกลือที่เกี่ยวข้องกับสมดุลไอออนิก
ปฏิกิริยาของเกลือในน้ำ
จะแสดงให้ทราบในภายหลังว่าความสามารถในการละลายเป็นแนวคิดที่สัมพันธ์กัน อย่างไรก็ตาม เพื่อวัตถุประสงค์ของการสนทนาข้างหน้า เราสามารถแบ่งเกลือทั้งหมดคร่าวๆ ออกเป็นเกลือที่ละลายน้ำได้และไม่ละลายในน้ำ
เกลือบางชนิดจะเกิดสารละลายที่เป็นกลางเมื่อละลายในน้ำ เกลืออื่นๆ จะเกิดเป็นสารละลายที่เป็นกรดหรือด่าง นี่เป็นเพราะการเกิดปฏิกิริยาย้อนกลับได้ระหว่างเกลือไอออนกับน้ำซึ่งเป็นผลมาจากการที่กรดหรือเบสคอนจูเกตเกิดขึ้น ไม่ว่าสารละลายเกลือจะเป็นกลาง เป็นกรด หรือด่างหรือไม่นั้น ขึ้นอยู่กับประเภทของเกลือ ในความหมายนี้เกลือมีสี่ประเภท
เกลือที่เกิดจากกรดแก่และเบสอ่อน เกลือประเภทนี้เมื่อละลายในน้ำจะเกิดเป็นสารละลายที่เป็นกรด ให้เรายกตัวอย่างแอมโมเนียมคลอไรด์ NH4Cl เมื่อเกลือนี้ละลายในน้ำ แอมโมเนียมไอออนจะทำหน้าที่เป็นดังนี้
ปริมาณไอออน H3O+ ที่มากเกินไปที่เกิดขึ้นในกระบวนการนี้ทำให้เกิดคุณสมบัติเป็นกรดของสารละลาย
เกลือที่เกิดจากกรดอ่อนและเบสแก่ เกลือประเภทนี้เมื่อละลายในน้ำจะเกิดเป็นสารละลายด่าง ตัวอย่างเช่น ลองใช้โซเดียมอะซิเตต CH3COONa1 แทน อะซิเตตไอออนจะทำหน้าที่เป็นเบสโดยรับโปรตอนจากน้ำซึ่งในกรณีนี้จะทำหน้าที่เป็นกรด:
ปริมาณ OH- ไอออนที่มากเกินไปที่เกิดขึ้นในกระบวนการนี้จะกำหนดคุณสมบัติเป็นด่างของสารละลาย
เกลือที่เกิดจากกรดแก่และเบสแก่ เมื่อเกลือประเภทนี้ละลายในน้ำจะเกิดสารละลายที่เป็นกลาง ลองใช้โซเดียมคลอไรด์ NaCl เป็นตัวอย่าง เมื่อละลายในน้ำ เกลือนี้จะถูกแตกตัวเป็นไอออนอย่างสมบูรณ์ ดังนั้น ความเข้มข้นของ Na+ ไอออนจึงเท่ากับความเข้มข้นของ Cl-ion เนื่องจากไม่มีไอออนใดไอออนหนึ่งหรือไอออนอื่นใดที่ไม่เกิดปฏิกิริยากรด-เบสกับน้ำ ปริมาณไอออน H3O+ หรือ OH ที่มากเกินไปจึงไม่ก่อตัวในสารละลาย ดังนั้นวิธีแก้ปัญหาจึงกลายเป็นกลาง
เกลือที่เกิดจากกรดอ่อนและเบสอ่อน ตัวอย่างของเกลือประเภทนี้คือแอมโมเนียมอะซิเตต เมื่อละลายในน้ำ แอมโมเนียมไอออนจะทำปฏิกิริยากับน้ำเป็นกรด และอะซิเตตไอออนจะทำปฏิกิริยากับน้ำเป็นเบส ปฏิกิริยาทั้งสองนี้ได้อธิบายไว้ข้างต้น สารละลายที่เป็นน้ำของเกลือที่เกิดจากกรดอ่อนและเบสอ่อนอาจเป็นกรดอ่อน เป็นด่างอ่อน หรือเป็นกลาง ขึ้นอยู่กับความเข้มข้นสัมพัทธ์ของไอออน H3O+ และ OH- ที่เกิดขึ้นอันเป็นผลมาจากปฏิกิริยาของไอออนบวกของเกลือและ แอนไอออนด้วยน้ำ ขึ้นอยู่กับความสัมพันธ์ระหว่างค่าของค่าคงที่การแยกตัวของไอออนบวกและไอออน
ตารางความสามารถในการละลายขององค์ประกอบทางเคมีคือตารางที่มีความสามารถในการละลายน้ำของกรดอนินทรีย์ เบส และเกลือที่มีชื่อเสียงที่สุด
คำจำกัดความ 1
ตารางความสามารถในการละลายในทางเคมีแสดงความสามารถในการละลายที่ 20 °C ความสามารถในการละลายจะเพิ่มขึ้นตามอุณหภูมิที่เพิ่มขึ้น
สารสามารถละลายในน้ำได้หากมีความสามารถในการละลายมากกว่า 1 กรัมต่อน้ำ 100 กรัม และไม่ละลายน้ำหากน้อยกว่า 0.1 กรัม/100 กรัม ตัวอย่างเช่น เมื่อหาลิเธียมในตารางความสามารถในการละลายในวิชาเคมี คุณจะมั่นใจได้ว่าเกือบทั้งหมด ของสารละลายในรูปแบบเกลือ
ในรูป 1 และรูป รูปที่ 2 แสดงภาพถ่ายตารางความสามารถในการละลายที่สมบูรณ์ในทางเคมีพร้อมชื่อของกรดตกค้าง
รูปที่ 1 ตารางความสามารถในการละลายภาพถ่ายในวิชาเคมีปี 2561-2562
รูปที่ 2 ตารางเคมีที่มีกรดและกรดตกค้าง
ในการตั้งชื่อเกลือ คุณต้องใช้ตารางธาตุและความสามารถในการละลาย ชื่อของกรดตกค้างจะถูกเพิ่มเข้าไปในชื่อของโลหะจากตารางธาตุ เช่น
$\mathrm(Zn_3(PO_4)_2)$ - ซิงค์ฟอสเฟต; $\mathrm(FeSO_4)$ - เหล็ก (II) ซัลเฟต
ในวงเล็บที่มีชื่อข้อความคุณต้องระบุความจุของโลหะหากมีหลายอัน ในกรณีของเหล็ก ยังมีเกลือ $\mathrm(Fe_2(SO_4)_3)$ - เหล็ก (III) ซัลเฟต
คุณสามารถเรียนรู้อะไรได้บ้างโดยใช้ตารางความสามารถในการละลายในวิชาเคมี
ตารางความสามารถในการละลายของสารในเคมีที่มีตะกอนใช้เพื่อระบุความเป็นไปได้ของปฏิกิริยาใดๆ ที่เกิดขึ้น เนื่องจากจำเป็นต้องมีการก่อตัวของตะกอนหรือก๊าซเพื่อให้เกิดปฏิกิริยาที่ไม่สามารถเปลี่ยนกลับคืนสภาพเดิมได้
ตารางความสามารถในการละลายของเกลือ กรด และเบสถือเป็นรากฐาน หากปราศจากความรู้ทางเคมีอย่างถ่องแท้แล้ว ก็เป็นไปไม่ได้ ความสามารถในการละลายของฐานและเกลือช่วยในการเรียนรู้ไม่เพียง แต่สำหรับเด็กนักเรียนเท่านั้น แต่ยังสำหรับผู้ประกอบอาชีพด้วย การสร้างผลิตภัณฑ์แห่งชีวิตมากมายไม่สามารถทำได้หากไม่มีความรู้นี้
ตารางความสามารถในการละลายกรด เกลือ และเบสในน้ำ
ตารางความสามารถในการละลายของเกลือและเบสในน้ำเป็นแนวทางที่ช่วยในการเชี่ยวชาญพื้นฐานทางเคมี หมายเหตุต่อไปนี้จะช่วยให้คุณเข้าใจตารางด้านล่าง
- P – หมายถึงสารที่ละลายน้ำได้
- H – สารที่ไม่ละลายน้ำ;
- M – สารละลายได้เล็กน้อยในสภาพแวดล้อมที่เป็นน้ำ
- RK - สารที่สามารถละลายได้เมื่อสัมผัสกับกรดอินทรีย์เข้มข้นเท่านั้น
- เส้นประจะบ่งบอกว่าสิ่งมีชีวิตดังกล่าวไม่มีอยู่ในธรรมชาติ
- NK – ไม่ละลายในกรดหรือน้ำ
- ? – เครื่องหมายคำถามแสดงว่าวันนี้ไม่มีข้อมูลที่ถูกต้องเกี่ยวกับการละลายของสาร

บ่อยครั้งที่นักเคมีและเด็กนักเรียนใช้ตารางนี้เพื่อทำการวิจัยในห้องปฏิบัติการซึ่งในระหว่างนั้นจำเป็นต้องกำหนดเงื่อนไขสำหรับการเกิดปฏิกิริยาบางอย่าง เมื่อใช้ตาราง คุณสามารถระบุได้ว่าสารจะมีพฤติกรรมอย่างไรในเกลือหรือสภาพแวดล้อมที่เป็นกรด และอาจมีตะกอนเกิดขึ้นหรือไม่ การตกตะกอนระหว่างการวิจัยและการทดลองบ่งชี้ว่าปฏิกิริยากลับไม่ได้ นี่เป็นจุดสำคัญที่อาจส่งผลต่อการปฏิบัติงานในห้องปฏิบัติการทั้งหมด
| แคตไอออน | แอนไอออน | |||||||||
| ฉ- | Cl- | บ- | ฉัน - | เอส 2- | หมายเลข 3 - | คาร์บอนไดออกไซด์ 3 2- | ไซโอ 3 2- | ดังนั้น 4 2- | ป.4 3- | |
| นา+ | ร | ร | ร | ร | ร | ร | ร | ร | ร | ร |
| เค+ | ร | ร | ร | ร | ร | ร | ร | ร | ร | ร |
| NH4+ | ร | ร | ร | ร | ร | ร | ร | ร | ร | ร |
| มก.2+ | อาร์เค | ร | ร | ร | ม | ร | เอ็น | อาร์เค | ร | อาร์เค |
| Ca2+ | เอ็นเค | ร | ร | ร | ม | ร | เอ็น | อาร์เค | ม | อาร์เค |
| ซีเนียร์ 2+ | เอ็นเค | ร | ร | ร | ร | ร | เอ็น | อาร์เค | อาร์เค | อาร์เค |
| บา 2+ | อาร์เค | ร | ร | ร | ร | ร | เอ็น | อาร์เค | เอ็นเค | อาร์เค |
| เอสเอ็น 2+ | ร | ร | ร | ม | อาร์เค | ร | เอ็น | เอ็น | ร | เอ็น |
| ปบี 2+ | เอ็น | ม | ม | ม | อาร์เค | ร | เอ็น | เอ็น | เอ็น | เอ็น |
| อัล 3+ | ม | ร | ร | ร | ช | ร | ช | เอ็นเค | ร | อาร์เค |
| Cr3+ | ร | ร | ร | ร | ช | ร | ช | เอ็น | ร | อาร์เค |
| ม.2+ | ร | ร | ร | ร | เอ็น | ร | เอ็น | เอ็น | ร | เอ็น |
| เฟ 2+ | ม | ร | ร | ร | เอ็น | ร | เอ็น | เอ็น | ร | เอ็น |
| เฟ 3+ | ร | ร | ร | - | - | ร | ช | เอ็น | ร | อาร์เค |
| โค2+ | ม | ร | ร | ร | เอ็น | ร | เอ็น | เอ็น | ร | เอ็น |
| นิ2+ | ม | ร | ร | ร | อาร์เค | ร | เอ็น | เอ็น | ร | เอ็น |
| คิว 2+ | ม | ร | ร | - | เอ็น | ร | ช | เอ็น | ร | เอ็น |
| สังกะสี 2+ | ม | ร | ร | ร | อาร์เค | ร | เอ็น | เอ็น | ร | เอ็น |
| ซีดี2+ | ร | ร | ร | ร | อาร์เค | ร | เอ็น | เอ็น | ร | เอ็น |
| ปรอท 2+ | ร | ร | ม | เอ็นเค | เอ็นเค | ร | เอ็น | เอ็น | ร | เอ็น |
| ปรอท 2 2+ | ร | เอ็นเค | เอ็นเค | เอ็นเค | อาร์เค | ร | เอ็น | เอ็น | ม | เอ็น |
| เอจี+ | ร | เอ็นเค | เอ็นเค | เอ็นเค | เอ็นเค | ร | เอ็น | เอ็น | ม | เอ็น |
ตำนาน:
P - สารนี้ละลายได้สูงในน้ำ M - ละลายได้เล็กน้อย H - แทบไม่ละลายในน้ำ แต่ละลายได้ง่ายในกรดอ่อนหรือเจือจาง RK - ไม่ละลายในน้ำและละลายได้ในกรดอนินทรีย์เข้มข้นเท่านั้น NK - ไม่ละลายในน้ำหรือกรด G - ไฮโดรไลซ์โดยสมบูรณ์เมื่อละลายและไม่สัมผัสกับน้ำ เส้นประหมายความว่าไม่มีสารดังกล่าวอยู่เลย
ในสารละลายที่เป็นน้ำ เกลือจะแยกตัวออกเป็นไอออนทั้งหมดหรือบางส่วน เกลือของกรดอ่อนและ/หรือเบสอ่อนจะผ่านการไฮโดรไลซิส สารละลายที่เป็นน้ำของเกลือประกอบด้วยไอออนไฮเดรต คู่ไอออน และรูปแบบทางเคมีที่ซับซ้อนมากขึ้น รวมถึงผลิตภัณฑ์ไฮโดรไลซิส เป็นต้น เกลือจำนวนหนึ่งยังละลายได้ในแอลกอฮอล์ อะซิโตน กรดเอไมด์ และตัวทำละลายอินทรีย์อื่นๆ
จากสารละลายที่เป็นน้ำ เกลือสามารถตกผลึกในรูปของคริสตัลไฮเดรต จากสารละลายที่ไม่ใช่น้ำ ในรูปของคริสตัลโซลเวต เช่น CaBr 2 3C 2 H 5 OH
ข้อมูลเกี่ยวกับกระบวนการต่างๆ ที่เกิดขึ้นในระบบเกลือน้ำ ความสามารถในการละลายของเกลือในข้อต่อซึ่งขึ้นอยู่กับอุณหภูมิ ความดัน และความเข้มข้น เกี่ยวกับองค์ประกอบของเฟสของแข็งและของเหลว สามารถรับได้โดยการศึกษาแผนภาพความสามารถในการละลายของระบบเกลือน้ำ
วิธีการทั่วไปในการสังเคราะห์เกลือ
1. การได้รับเกลือปานกลาง:
1) โลหะที่ไม่ใช่โลหะ: 2Na + Cl 2 = 2NaCl
2) โลหะที่มีกรด: Zn + 2HCl = ZnCl 2 + H 2
3) โลหะที่มีสารละลายเกลือของโลหะที่มีฤทธิ์น้อยกว่า Fe + CuSO 4 = FeSO 4 + Cu
4) ออกไซด์พื้นฐานที่มีออกไซด์ที่เป็นกรด: MgO + CO 2 = MgCO 3
5) ออกไซด์พื้นฐานที่มีกรด CuO + H 2 SO 4 = CuSO 4 + H 2 O
6) เบสที่มีกรดออกไซด์ Ba(OH) 2 + CO 2 = BaCO 3 + H 2 O
7) เบสที่มีกรด: Ca(OH) 2 + 2HCl = CaCl 2 + 2H 2 O
8) เกลือที่มีกรด: MgCO 3 + 2HCl = MgCl 2 + H 2 O + CO 2
BaCl 2 + H 2 SO 4 = BaSO 4 + 2HCl
9) สารละลายเบสพร้อมสารละลายเกลือ: Ba(OH) 2 + Na 2 SO 4 = 2NaOH + BaSO 4
10) สารละลายของเกลือสองตัว 3CaCl 2 + 2Na 3 PO 4 = Ca 3 (PO 4) 2 + 6NaCl
2. การได้รับเกลือที่เป็นกรด:
1. ปฏิกิริยาระหว่างกรดกับเบสที่ขาด เกาะ + H2SO4 = KHSO4 + H2O
2. ปฏิกิริยาระหว่างฐานกับกรดออกไซด์ส่วนเกิน
Ca(OH) 2 + 2CO 2 = Ca(HCO 3) 2
3. ปฏิกิริยาระหว่างเกลือโดยเฉลี่ยกับกรด Ca 3 (PO 4) 2 + 4H 3 PO 4 = 3Ca(H 2 PO 4) 2
3.การได้รับเกลือพื้นฐาน:
1. การไฮโดรไลซิสของเกลือที่เกิดจากเบสอ่อนและกรดแก่
สังกะสี 2 + H 2 O = Cl + HCl
2. การเติมอัลคาไลจำนวนเล็กน้อย (ทีละหยด) ลงในสารละลายของเกลือโลหะขนาดกลาง AlCl 3 + 2NaOH = Cl + 2NaCl
3. ปฏิกิริยาระหว่างเกลือของกรดอ่อนกับเกลือปานกลาง
2MgCl 2 + 2Na 2 CO 3 + H 2 O = 2 CO 3 + CO 2 + 4NaCl
4. การได้รับเกลือเชิงซ้อน:
1. ปฏิกิริยาของเกลือกับลิแกนด์: AgCl + 2NH 3 = Cl
FeCl 3 + 6KCN] = K 3 + 3KCl
5. การได้รับเกลือสองเท่า:
1. การตกผลึกร่วมกันของเกลือสองชนิด:
Cr 2 (SO 4) 3 + K 2 SO 4 + 24H 2 O = 2 + NaCl
4. ปฏิกิริยารีดอกซ์ที่เกิดจากคุณสมบัติของไอออนบวกหรือไอออนลบ 2KMnO 4 + 16HCl = 2MnCl 2 + 2KCl + 5Cl 2 + 8H 2 O
2. คุณสมบัติทางเคมีของเกลือกรด:
1. การสลายตัวด้วยความร้อนด้วยการก่อตัวของเกลือปานกลาง
Ca(HCO 3) 2 = CaCO 3 + CO 2 + H 2 O
2. ปฏิกิริยากับด่าง ได้เกลือปานกลาง
บา(HCO 3) 2 + บา(OH) 2 = 2 BaCO 3 + 2H 2 O
3. คุณสมบัติทางเคมีของเกลือพื้นฐาน:
1. การสลายตัวด้วยความร้อน 2 CO 3 = 2CuO + CO 2 + H 2 O
2. การทำปฏิกิริยากับกรด: การก่อตัวของเกลือปานกลาง
Sn(OH)Cl + HCl = SnCl 2 + H 2 O
4. คุณสมบัติทางเคมีของเกลือเชิงซ้อน:
1. การทำลายเชิงซ้อนเนื่องจากการก่อตัวของสารประกอบที่ละลายน้ำได้ไม่ดี:
2Cl + K2S = CuS + 2KCl + 4NH3
2. การแลกเปลี่ยนลิแกนด์ระหว่างทรงกลมด้านนอกและด้านใน
K 2 + 6H 2 O = Cl 2 + 2KCl
5. คุณสมบัติทางเคมีของเกลือคู่:
1. การทำปฏิกิริยากับสารละลายอัลคาไล: KCr(SO 4) 2 + 3KOH = Cr(OH) 3 + 2K 2 SO 4
2. การลดลง: KCr(SO 4) 2 + 2H°(Zn, dil. H 2 SO 4) = 2CrSO 4 + H 2 SO 4 + K 2 SO 4
วัตถุดิบสำหรับการผลิตทางอุตสาหกรรมของเกลือจำนวนหนึ่ง - คลอไรด์, ซัลเฟต, คาร์บอเนต, บอเรต Na, K, Ca, Mg คือน้ำทะเลและน้ำทะเลน้ำเกลือธรรมชาติที่เกิดขึ้นระหว่างการระเหยและการสะสมของเกลือที่เป็นของแข็ง สำหรับกลุ่มแร่ธาตุที่สะสมตัวเป็นเกลือตะกอน (ซัลเฟตและคลอไรด์ของ Na, K และ Mg) จะใช้ชื่อทั่วไปว่า "เกลือธรรมชาติ" แหล่งเกลือโพแทสเซียมที่ใหญ่ที่สุดตั้งอยู่ในรัสเซีย (Solikamsk) แคนาดาและเยอรมนี แหล่งแร่ฟอสเฟตที่ทรงพลังอยู่ในแอฟริกาเหนือ รัสเซีย และคาซัคสถาน ส่วน NaNO3 อยู่ในชิลี
เกลือถูกใช้ในอุตสาหกรรมอาหาร เคมี โลหะ แก้ว เครื่องหนัง สิ่งทอ เกษตรกรรม ยา ฯลฯ
เกลือประเภทหลัก
1. บอเรต (ออกโซโบเรต) เกลือของกรดบอริก: เมตาบอริก HBO 2, ออร์โธบอริก H3 BO 3 และกรดโพลีโบโรนิกที่ไม่ได้แยกในสถานะอิสระ ขึ้นอยู่กับจำนวนอะตอมของโบรอนในโมเลกุลพวกมันจะถูกแบ่งออกเป็นโมโน -, ได, เตตร้า -, เฮกซาบอเรต ฯลฯ บอเรตยังถูกเรียกโดยกรดที่ก่อตัวพวกมันและตามจำนวนโมลของ B 2 O 3 ต่อ 1 โมลของออกไซด์หลัก ดังนั้นสารเมตาบอเรตต่างๆ จึงสามารถเรียกว่าโมโนบอเรตได้หากมีไอออน B(OH)4 หรือไอออนลูกโซ่ (BO2) ไม่ ไม่ - diborates - หากมีไอออนคู่แบบโซ่ (B 2 O 3 (OH) 2) ไม่มี 2n- triborates - หากมีไอออนวงแหวน (B 3 O 6) 3-
โครงสร้างของบอเรตประกอบด้วยกลุ่มโบรอน-ออกซิเจน - "บล็อก" ที่มีตั้งแต่ 1 ถึง 6 และบางครั้งมีอะตอมโบรอน 9 อะตอม เช่น:
จำนวนพิกัดของอะตอมโบรอนคือ 3 (กลุ่มสามเหลี่ยมโบรอน-ออกซิเจน) หรือ 4 (กลุ่มจัตุรมุข) หมู่โบรอน-ออกซิเจนเป็นพื้นฐานของไม่เพียงแต่เกาะเท่านั้น แต่ยังรวมถึงโครงสร้างที่ซับซ้อนกว่าด้วย เช่น โซ่ ชั้น และเฟรมโพลีเมอร์ไรซ์ หลังเกิดขึ้นจากการกำจัดน้ำในโมเลกุลบอเรตไฮเดรตและการก่อตัวของพันธะเชื่อมผ่านอะตอมออกซิเจน บางครั้งกระบวนการนี้มาพร้อมกับความแตกแยกของพันธะ B-O ภายในโพลิแอนไอออน Polyanions สามารถแนบกลุ่มด้านข้าง - โบรอน - ออกซิเจน tetrahedra หรือสามเหลี่ยม, dimers หรือ anions ภายนอก
แอมโมเนียมอัลคาไลรวมถึงโลหะอื่น ๆ ในสถานะออกซิเดชัน +1 ส่วนใหญ่มักจะก่อให้เกิดสารเมตาบอเรตที่มีไฮเดรตและปราศจากน้ำเช่น MBO 2, tetraborates M 2 B 4 O 7, pentaborates MB 5 O 8 เช่นเดียวกับ decaborates M 4 B 10 O 17 n H 2 O. อัลคาไลน์เอิร์ทและโลหะอื่น ๆ ในสถานะออกซิเดชัน + 2 มักจะให้สารเมตาบอเรตไฮเดรต, ไตรบอเรต M 2 B 6 O 11 และเฮกซาบอเรต MB 6 O 10 เช่นเดียวกับเมตา-, ออร์โธ- และเตตราบอเรตที่ปราศจากน้ำ โลหะในสถานะออกซิเดชัน + 3 มีลักษณะเฉพาะด้วยออร์โทบอเรต MBO 3 ที่มีไฮเดรตและปราศจากน้ำ
บอเรตเป็นสารหรือผลึกอสัณฐานไม่มีสี (ส่วนใหญ่มีโครงสร้างสมมาตรต่ำ - โมโนคลินิกหรือออร์โธฮอมบิก) สำหรับบอเรตแบบแอนไฮดรัส อุณหภูมิหลอมเหลวอยู่ระหว่าง 500 ถึง 2000 °C; จุดหลอมเหลวสูงสุดคือเมตาบอเรตของอัลคาไล และออร์โธ-และเมตาบอเรตของโลหะอัลคาไลน์เอิร์ธ บอเรตส่วนใหญ่จะก่อตัวเป็นแก้วทันทีเมื่อของเหลวที่ละลายถูกทำให้เย็นลง ความแข็งของบอเรตไฮเดรตในระดับ Mohs คือ 2-5 ไม่มีน้ำ - สูงถึง 9
โมโนบอเรตที่ถูกไฮเดรตจะสูญเสียน้ำจากการตกผลึกสูงถึง ~180°C, โพลีบอเรต - ที่ 300-500°C; การกำจัดน้ำเนื่องจากหมู่ OH , การประสานงานรอบอะตอมของโบรอนเกิดขึ้นได้สูงถึง ~750°C เมื่อเกิดภาวะขาดน้ำโดยสมบูรณ์ จะเกิดสารอสัณฐานขึ้น ซึ่งในกรณีส่วนใหญ่ที่อุณหภูมิ 500-800°C จะผ่านการ "จัดเรียงบอเรตใหม่" - การตกผลึกพร้อมกับ (สำหรับโพลีบอเรต) โดยการสลายตัวบางส่วนด้วยการปล่อย B 2 O 3
บอเรตของโลหะอัลคาไล แอมโมเนียม และ T1(I) ละลายได้ในน้ำ (โดยเฉพาะเมตาดาต้าและเพนทาบอเรต) และไฮโดรไลซ์ในสารละลายที่เป็นน้ำ (สารละลายมีปฏิกิริยาเป็นด่าง) บอเรตส่วนใหญ่จะสลายตัวได้ง่ายด้วยกรด ในบางกรณีอาจเกิดจากการกระทำของ CO 2 ; และดังนั้น 2 ;. บอเรตของอัลคาไลน์เอิร์ธและโลหะหนักทำปฏิกิริยากับสารละลายของอัลคาไล คาร์บอเนต และไฮโดรคาร์บอเนตของโลหะอัลคาไล บอเรตชนิดแอนไฮดรัสมีความเสถียรทางเคมีมากกว่าบอเรตไฮเดรต บอเรตจะสร้างสารเชิงซ้อนที่ละลายน้ำได้ในแอลกอฮอล์บางชนิด โดยเฉพาะกลีเซอรอล ภายใต้การกระทำของสารออกซิไดซ์ที่แรงโดยเฉพาะ H 2 O 2 หรือในระหว่างการออกซิเดชันเคมีไฟฟ้า บอเรตจะถูกแปลงเป็นเปอร์รอกโซโบเรต .
รู้จักบอเรตธรรมชาติประมาณ 100 ชนิด ซึ่งส่วนใหญ่เป็นเกลือของ Na, Mg, Ca, Fe
ได้รับบอเรตไฮเดรต: โดยการทำให้เป็นกลางของ H 3 VO 3 ด้วยออกไซด์ของโลหะไฮดรอกไซด์หรือคาร์บอเนต แลกเปลี่ยนปฏิกิริยาของบอเรตโลหะอัลคาไลซึ่งส่วนใหญ่มักเป็น Na กับเกลือของโลหะอื่น ๆ ปฏิกิริยาของการเปลี่ยนแปลงร่วมกันของบอเรตที่ละลายน้ำได้ไม่ดีกับสารละลายที่เป็นน้ำของบอเรตโลหะอัลคาไล กระบวนการไฮโดรเทอร์มอลโดยใช้เฮไลด์ของโลหะอัลคาไลเป็นสารเติมแต่งแร่ บอเรตปราศจากน้ำได้มาจากการหลอมหรือการเผา B 2 O 3 ด้วยออกไซด์ของโลหะหรือคาร์บอเนตหรือการคายน้ำของไฮเดรต ผลึกเดี่ยวปลูกในสารละลายบอเรตในออกไซด์หลอมเหลว เช่น Bi 2 O 3
มีการใช้บอเรต: เพื่อให้ได้สารประกอบโบรอนอื่นๆ เป็นส่วนประกอบประจุไฟฟ้าในการผลิตแก้ว สารเคลือบ สารเคลือบ เซรามิก สำหรับการเคลือบและการเคลือบทนไฟ เป็นส่วนประกอบของฟลักซ์สำหรับการทำให้บริสุทธิ์ การเชื่อม และการบัดกรีโลหะ”; เป็นเม็ดสีและสารตัวเติมสำหรับสีและวาร์นิช สารยับยั้งการกัดกร่อน ส่วนประกอบของอิเล็กโทรไลต์ สารเรืองแสง ฯลฯ มีการใช้บอแรกซ์และแคลเซียมบอเรตกันอย่างแพร่หลาย
2.เฮไลด์ สารประกอบทางเคมีของฮาโลเจนกับธาตุอื่น เฮไลด์มักจะรวมถึงสารประกอบที่อะตอมของฮาโลเจนมีอิเล็กโตรเนกาติวีตี้มากกว่าธาตุอื่น เฮไลด์ไม่ได้เกิดจาก He, Ne และ Ar สู่ EC เฮไลด์แบบง่ายหรือแบบไบนารี n (n- ส่วนใหญ่มักจะเป็นจำนวนเต็มตั้งแต่ 1 สำหรับโมโนฮาไลด์ถึง 7 สำหรับ IF 7 และ ReF 7 แต่ก็สามารถเป็นเศษส่วนได้เช่นกัน เช่น 7/6 สำหรับ Bi 6 Cl 7) รวมถึงเกลือของกรดไฮโดรฮาลิกและสารประกอบอินเตอร์ฮาโลเจนโดยเฉพาะ (ตัวอย่างเช่น , ฮาโลฟลูออไรด์) นอกจากนี้ยังมีเฮไลด์ผสม, โพลีเฮไลด์, ไฮโดรเฮไลด์, ออกโซฮาไลด์, ออกซีเฮไลด์, ไฮดรอกโซฮาไลด์, ไทโอฮาไลด์ และเฮไลด์เชิงซ้อน เลขออกซิเดชันของฮาโลเจนในเฮไลด์มักจะเป็น -1
ขึ้นอยู่กับธรรมชาติของพันธะธาตุ-ฮาโลเจน เฮไลด์เชิงเดี่ยวจะถูกแบ่งออกเป็นไอออนิกและโควาเลนต์ ในความเป็นจริง การเชื่อมต่อมีลักษณะผสมผสานโดยมีส่วนสนับสนุนจากองค์ประกอบหนึ่งหรือองค์ประกอบอื่น เฮไลด์ของโลหะอัลคาไลและอัลคาไลน์เอิร์ธ เช่นเดียวกับโมโน- และไดฮาไลด์ของโลหะอื่นๆ หลายชนิด เป็นเกลือทั่วไปที่ธรรมชาติของพันธะไอออนิกมีอิทธิพลเหนือกว่า ส่วนใหญ่ค่อนข้างทนไฟ ระเหยได้ต่ำ และละลายได้สูงในน้ำ ในสารละลายที่เป็นน้ำจะแยกตัวออกเป็นไอออนเกือบทั้งหมด ไตรฮาไลด์ของธาตุหายากก็มีคุณสมบัติของเกลือเช่นกัน ความสามารถในการละลายของไอออนิกเฮไลด์ในน้ำโดยทั่วไปจะลดลงจากไอโอไดด์ไปเป็นฟลูออไรด์ คลอไรด์ โบรไมด์ และไอโอไดด์ Ag + , Cu + , Hg + และ Pb 2+ ละลายในน้ำได้ไม่ดี
การเพิ่มจำนวนอะตอมฮาโลเจนในโลหะเฮไลด์หรืออัตราส่วนของประจุของโลหะต่อรัศมีของไอออนทำให้องค์ประกอบโควาเลนต์ของพันธะเพิ่มขึ้น ความสามารถในการละลายในน้ำลดลง และเสถียรภาพทางความร้อนของเฮไลด์ การเพิ่มขึ้นของความผันผวน การเกิดออกซิเดชันที่เพิ่มขึ้น ความสามารถและแนวโน้มที่จะไฮโดรไลซิส การขึ้นต่อกันเหล่านี้สังเกตได้จากโลหะเฮไลด์ในช่วงเวลาเดียวกันและในชุดของเฮไลด์ของโลหะชนิดเดียวกัน สามารถสังเกตได้ง่ายโดยใช้ตัวอย่างคุณสมบัติทางความร้อน ตัวอย่างเช่น สำหรับโลหะเฮไลด์ในช่วงที่ 4 จุดหลอมเหลวและจุดเดือดอยู่ที่ 771 และ 1430°C สำหรับ KC1, 772 และ 1960°C สำหรับ CaCl2, 967 และ 975°C สำหรับ ScCl3, -24.1 และ 136°C สำหรับ TiCl4 ตามลำดับ . สำหรับ UF 3 จุดหลอมเหลวคือ ~ 1500°C, UF 4 · 1,036°C, UF 5 · 348°C, UF 6 · 64.0°C ในแถวการเชื่อมต่อ EH nมีค่าคงที่ nค่าโควาเลนต์ของพันธะมักจะเพิ่มขึ้นเมื่อเปลี่ยนจากฟลูออไรด์เป็นคลอไรด์ และลดลงเมื่อเปลี่ยนจากฟลูออไรด์เป็นโบรไมด์และไอโอไดด์ ดังนั้น สำหรับ AlF 3 อุณหภูมิการระเหิดคือ 1280°C, AlC1 3 คือ 180°C จุดเดือด AlBr 3 คือ 254.8°C, AlI 3 คือ 407°C ในซีรีส์ ZrF 4 , ZrCl 4 ZrBr 4 , ZrI 4 อุณหภูมิการระเหิดคือ 906, 334, 355 และ 418°C ตามลำดับ ในตำแหน่ง MF nและเอ็มซี1 nโดยที่ M เป็นโลหะของกลุ่มย่อยหนึ่ง ค่าโควาเลนต์ของพันธะจะลดลงเมื่อมวลอะตอมของโลหะเพิ่มขึ้น มีฟลูออไรด์และคลอไรด์ของโลหะอยู่ไม่กี่ชนิดที่มีส่วนร่วมเท่ากันโดยประมาณจากส่วนประกอบพันธะไอออนิกและโควาเลนต์
พลังงานพันธะฮาโลเจนของธาตุโดยเฉลี่ยจะลดลงเมื่อเคลื่อนที่จากฟลูออไรด์ไปเป็นไอโอไดด์และเพิ่มขึ้น n(ดูตาราง)
โลหะเฮไลด์หลายชนิดที่มีอะตอม O ที่แยกหรือเชื่อมโยงกัน (ออกโซ- และออกซีเฮไลด์ ตามลำดับ) เช่น วานาเดียมออกโซไตรฟลูออไรด์ VOF 3, ไนโอเบียมไดออกซีฟลูออไรด์ NbO 2 F, ทังสเตนไดออกโซ-ไอโอไดด์ WO 2 I 2
เฮไลด์เชิงซ้อน (ฮาโลเมทัลเลต) มีไอออนเชิงซ้อนซึ่งอะตอมของฮาโลเจนคือลิแกนด์ ตัวอย่างเช่น โพแทสเซียมเฮกซะคลอโรพลาทิเนต (IV) K2, โซเดียมเฮปตาฟลูออโรแทนทาเลต (V), โซเดียม, ลิเธียมเฮกซาฟลูออโรอาร์เซเนต (V) ฟลูออโร- ออกโซฟลูออโร- และคลอโรเมทัลเลตมีเสถียรภาพทางความร้อนสูงสุด โดยธรรมชาติของพันธะสารประกอบไอออนิกที่มีไอออนบวก NF 4 +, N 2 F 3 +, C1F 2 +, XeF + ฯลฯ มีความคล้ายคลึงกับเฮไลด์เชิงซ้อน
เฮไลด์หลายชนิดมีลักษณะเฉพาะโดยการเชื่อมโยงและการเกิดพอลิเมอไรเซชันในเฟสของเหลวและก๊าซพร้อมกับการก่อตัวของพันธะเชื่อม สิ่งที่มีแนวโน้มมากที่สุดคือโลหะเฮไลด์ของกลุ่ม I และ II, AlCl 3, เพนทาฟลูออไรด์ของ Sb และโลหะทรานซิชัน, ออกโซฟลูออไรด์ขององค์ประกอบ MOF 4 เฮไลด์ที่มีพันธะระหว่างโลหะกับโลหะเป็นที่รู้จัก เช่น Cl-Hg-Hg-Cl
ฟลูออไรด์มีคุณสมบัติแตกต่างจากเฮไลด์อื่นๆ อย่างมีนัยสำคัญ อย่างไรก็ตาม ในเฮไลด์เชิงซ้อน ความแตกต่างเหล่านี้จะเด่นชัดน้อยกว่าในฮาโลเจนเอง และในเฮไลด์เชิงซ้อนจะเด่นชัดน้อยกว่าในเฮไลด์เชิงเดี่ยว
โควาเลนต์เฮไลด์หลายชนิด (โดยเฉพาะฟลูออไรด์) เป็นกรดลิวอิสชนิดเข้มข้น เช่น AsF 5, SbF 5, BF 3, A1C1 3. ฟลูออไรด์เป็นส่วนหนึ่งของกรดซุปเปอร์ เฮไลด์ที่สูงขึ้นจะถูกรีดิวซ์โดยโลหะและไฮโดรเจน ตัวอย่างเช่น:
5WF 6 + W = 6WF 5
TiCl 4 + 2Mg = Ti + 2MgCl 2
ยูเอฟ 6 + ชม 2 = ยูเอฟ 4 + 2HF
โลหะเฮไลด์ของกลุ่ม V-VIII ยกเว้น Cr และ Mn จะถูกรีดิวซ์โดย H 2 ให้เป็นโลหะ ตัวอย่างเช่น:
WF 6 + ZN 2 = W + 6HF
โลหะเฮไลด์โควาเลนต์และไอออนิกจำนวนมากทำปฏิกิริยากันจนเกิดเป็นเฮไลด์เชิงซ้อน ตัวอย่างเช่น:
KS1 + TaCl 5 = K
ฮาโลเจนที่เบากว่าสามารถแทนที่เฮไลด์ที่หนักกว่าได้ ออกซิเจนสามารถออกซิไดซ์เฮไลด์ โดยปล่อย C1 2, Br 2 และ I 2 ปฏิกิริยาลักษณะเฉพาะอย่างหนึ่งของโควาเลนต์เฮไลด์คือการทำปฏิกิริยากับน้ำ (ไฮโดรไลซิส) หรือไอของมันเมื่อถูกความร้อน (ไพโรไฮโดรไลซิส) ซึ่งนำไปสู่การก่อตัวของออกไซด์ ออกซีหรือออกโซฮาไลด์ ไฮดรอกไซด์และไฮโดรเจนเฮไลด์
เฮไลด์ได้โดยตรงจากธาตุ โดยปฏิกิริยาของไฮโดรเจนเฮไลด์หรือกรดไฮโดรฮาลิกกับธาตุ ออกไซด์ ไฮดรอกไซด์ หรือเกลือ ตลอดจนจากปฏิกิริยาการแลกเปลี่ยน
เฮไลด์ถูกนำมาใช้กันอย่างแพร่หลายในเทคโนโลยีเป็นวัสดุเริ่มต้นสำหรับการผลิตโลหะฮาโลเจน โลหะอัลคาไลและอัลคาไลน์เอิร์ธ เป็นส่วนประกอบของแก้วและวัสดุอนินทรีย์อื่นๆ เป็นผลิตภัณฑ์ขั้นกลางในการผลิตโลหะหายากและโลหะที่ไม่ใช่เหล็กบางชนิด U, Si, Ge เป็นต้น
ในธรรมชาติ เฮไลด์จะก่อตัวเป็นแร่ธาตุแยกประเภทกัน ซึ่งรวมถึงฟลูออไรด์ (เช่น แร่ธาตุฟลูออไรต์ ไครโอไลต์) และคลอไรด์ (ซิลไวต์ คาร์นัลไลท์) โบรมีนและไอโอดีนมีอยู่ในแร่ธาตุบางชนิดเป็นสารเจือปนแบบไอโซมอร์ฟิก เฮไลด์ในปริมาณมากมีอยู่ในน้ำทะเลและมหาสมุทร เกลือ และน้ำเกลือใต้ดิน เฮไลด์บางชนิด เช่น NaCl, KC1, CaCl 2 เป็นส่วนหนึ่งของสิ่งมีชีวิต
3. คาร์บอเนต (จากภาษาละติน carbo, เพศ carbonis ถ่านหิน), เกลือของกรดคาร์บอนิก มีคาร์บอเนตขนาดกลางที่มี CO 3 2- ไอออนและเป็นกรดหรือไฮโดรคาร์บอเนต (ไบคาร์บอเนตเก่า) โดยมี HCO 3 - ไอออน คาร์บอเนตเป็นสารที่เป็นผลึก เกลือของโลหะขนาดกลางส่วนใหญ่ในสถานะออกซิเดชัน +2 จะตกผลึกเป็นรูปหกเหลี่ยม แคลไซต์ชนิดขัดแตะหรืออาราโกไนต์ชนิดขนมเปียกปูน
ในบรรดาคาร์บอเนตขนาดกลาง มีเพียงเกลือของโลหะอัลคาไล แอมโมเนียม และ Tl(I) เท่านั้นที่ละลายในน้ำได้ จากการไฮโดรไลซิสที่มีนัยสำคัญ สารละลายของพวกมันจึงมีปฏิกิริยาเป็นด่าง โลหะคาร์บอเนตละลายได้ยากที่สุดในสถานะออกซิเดชัน + 2 ในทางกลับกัน ไบคาร์บอเนตทั้งหมดละลายในน้ำได้สูง ในระหว่างปฏิกิริยาการแลกเปลี่ยนในสารละลายในน้ำระหว่างเกลือของโลหะกับ Na 2 CO 3 จะเกิดการตกตะกอนของคาร์บอเนตขนาดกลางในกรณีที่ความสามารถในการละลายน้อยกว่าของไฮดรอกไซด์ที่เกี่ยวข้องอย่างมีนัยสำคัญ นี่เป็นกรณีของ Ca, Sr และสารอะนาล็อก ได้แก่ แลนทาไนด์, Ag(I), Mn(II), Pb(II) และ Cd(II) ไอออนบวกที่เหลือเมื่อทำปฏิกิริยากับคาร์บอเนตที่ละลายอันเป็นผลมาจากการไฮโดรไลซิสสามารถให้สาร Crabonates พื้นฐานหรือแม้แต่ไฮดรอกไซด์ได้ ปูโอเนตขนาดกลางที่มีไอออนบวกที่มีประจุทวีคูณบางครั้งอาจตกตะกอนจากสารละลายที่เป็นน้ำเมื่อมี CO 2 มากเกินไป
คุณสมบัติทางเคมีของคาร์บอเนตเกิดจากการอยู่ในประเภทของเกลืออนินทรีย์ของกรดอ่อน คุณลักษณะเฉพาะของคาร์บอเนตมีความเกี่ยวข้องกับความสามารถในการละลายได้ไม่ดีตลอดจนความไม่เสถียรทางความร้อนของทั้งตัวปูและ H 2 CO 3 คุณสมบัติเหล่านี้ใช้ในการวิเคราะห์ Crabonates โดยขึ้นอยู่กับการสลายตัวด้วยกรดแก่และการดูดซับเชิงปริมาณของ CO 2 ที่เกิดขึ้นโดยสารละลายด่าง หรือการตกตะกอนของ CO 3 2- ไอออนจากสารละลายในรูปของ BaCO 3. เมื่อ CO 2 ส่วนเกินกระทำกับตะกอนคาร์บอเนตขนาดกลาง จะเกิดไฮโดรเจนคาร์บอเนตในสารละลาย ตัวอย่างเช่น CaCO 3 + H 2 O + CO 2 = Ca(HCO 3) 2 การมีอยู่ของไฮโดรคาร์บอเนตในน้ำธรรมชาติทำให้เกิดความกระด้างชั่วคราว เมื่อได้รับความร้อนเล็กน้อยแม้ที่อุณหภูมิต่ำ ไฮโดรคาร์บอเนตก็จะเปลี่ยนเป็นคาร์บอเนตขนาดกลางอีกครั้ง ซึ่งเมื่อถูกความร้อนจะสลายตัวเป็นออกไซด์และ CO 2 ยิ่งโลหะมีการเคลื่อนไหวมาก อุณหภูมิการสลายตัวของคาร์บอเนตก็จะยิ่งสูงขึ้นตามไปด้วย ดังนั้น Na 2 CO 3 จึงละลายโดยไม่มีการสลายตัวที่ 857 °C และสำหรับคาร์บอเนต Ca, Mg และ A1 ความดันการสลายตัวที่สมดุลจะสูงถึง 0.1 MPa ที่อุณหภูมิ 820, 350 และ 100 °C ตามลำดับ
คาร์บอเนตแพร่หลายมากในธรรมชาติซึ่งเกิดจากการมีส่วนร่วมของ CO 2 และ H 2 O ในกระบวนการสร้างแร่ธาตุ คาร์บอเนตมีบทบาทสำคัญในสมดุลของโลกระหว่างก๊าซ CO 2 ในชั้นบรรยากาศและ CO 2 ที่ละลายอยู่
และ HCO 3 - และ CO 3 2- ไอออนในไฮโดรสเฟียร์และเกลือแข็งในเปลือกโลก แร่ธาตุที่สำคัญที่สุด ได้แก่ แคลไซต์ CaCO 3, แมกนีไซต์ MgCO 3, ไซเดอไรต์ FeCO 3, สมิธโซไนต์ ZnCO 3 และอื่น ๆ หินปูนประกอบด้วยแคลไซต์เป็นส่วนใหญ่หรือซากโครงกระดูกแคลไซต์ของสิ่งมีชีวิตซึ่งไม่ค่อยมีอาราโกไนต์ คาร์บอเนตไฮเดรตตามธรรมชาติของโลหะอัลคาไลและ Mg (เช่น MgCO 3 ZH 2 O, Na 2 CO 3 · 10H 2 O), คาร์บอเนตสองชั้น [เช่น โดโลไมต์ CaMg(CO 3) 2, โทรนา Na 2 CO 3 NaHCO 3 2H 2 ยังเป็นที่รู้จัก O] และพื้นฐาน [มาลาไคต์ CuCO 3 Cu(OH) 2, ไฮโดรเซอรัสไซต์ 2PbCO 3 Pb(OH) 2]
ที่สำคัญที่สุดคือโพแทสเซียมคาร์บอเนต แคลเซียมคาร์บอเนต และโซเดียมคาร์บอเนต คาร์บอเนตธรรมชาติหลายชนิดเป็นแร่โลหะที่มีคุณค่ามาก (เช่น คาร์บอเนต Zn, Fe, Mn, Pb, Cu) ไบคาร์บอเนตมีบทบาททางสรีรวิทยาที่สำคัญ โดยเป็นสารบัฟเฟอร์ที่ควบคุมความคงตัวของ pH ในเลือด
4. ไนเตรต เกลือของกรดไนตริก HNO 3 รู้จักโลหะเกือบทั้งหมด มีอยู่ทั้งในรูปของเกลือแอนไฮดรัส M(NO 3) n (n- สถานะออกซิเดชันของโลหะ M) และในรูปของผลึกไฮเดรต M(NO 3) n xเอช 2 โอ ( เอ็กซ์= 1-9) สำหรับสารละลายที่เป็นน้ำที่อุณหภูมิใกล้กับอุณหภูมิห้อง มีเพียงไนเตรตโลหะอัลคาไลเท่านั้นที่ตกผลึกเป็นแอนไฮดรัส ส่วนที่เหลืออยู่ในรูปของผลึกไฮเดรต คุณสมบัติทางเคมีฟิสิกส์ของไนเตรตปราศจากน้ำและไฮเดรตของโลหะชนิดเดียวกันอาจแตกต่างกันอย่างมาก
สารประกอบผลึกไร้น้ำของไนเตรตองค์ประกอบ d มีสี ตามอัตภาพ ไนเตรตสามารถแบ่งออกเป็นสารประกอบที่มีพันธะโควาเลนต์เป็นส่วนใหญ่ (เกลือของ Be, Cr, Zn, Fe และโลหะทรานซิชันอื่นๆ) และมีพันธะประเภทไอออนิกเป็นส่วนใหญ่ (เกลือของโลหะอัลคาไลและโลหะอัลคาไลน์เอิร์ธ) ไอออนิกไนเตรตมีลักษณะพิเศษคือความเสถียรทางความร้อนที่สูงขึ้น ความเด่นของโครงสร้างผลึกที่มีความสมมาตรสูงกว่า (ลูกบาศก์) และไม่มีการแยกแถบไอออนไนเตรตในสเปกตรัม IR โควาเลนต์ไนเตรตมีความสามารถในการละลายได้สูงกว่าในตัวทำละลายอินทรีย์ มีความเสถียรทางความร้อนต่ำกว่า และสเปกตรัม IR ของพวกมันมีความซับซ้อนมากกว่า โควาเลนต์ไนเตรตบางชนิดสามารถระเหยได้ที่อุณหภูมิห้อง และเมื่อละลายในน้ำ จะสลายตัวบางส่วนและปล่อยไนโตรเจนออกไซด์ออกมา
ไนเตรตปราศจากน้ำทั้งหมดแสดงคุณสมบัติการออกซิไดซ์ที่แรงเนื่องจากมี NO 3 - ไอออน ในขณะที่ความสามารถในการออกซิไดซ์จะเพิ่มขึ้นเมื่อเปลี่ยนจากไอออนิกไปเป็นโควาเลนต์ไนเตรต อย่างหลังสลายตัวในช่วง 100-300°C ไอออนิก - ที่ 400-600°C (NaNO 3, KNO 3 และอื่นๆ บางส่วนละลายเมื่อถูกความร้อน) ผลิตภัณฑ์จากการสลายตัวในสถานะของแข็งและของเหลว เป็นไนไตรต์, ออกซิไนเตรตและออกไซด์ตามลำดับ, บางครั้งเป็นโลหะอิสระ (เมื่อออกไซด์ไม่เสถียรเช่น Ag 2 O) และในเฟสก๊าซ - NO, NO 2, O 2 และ N 2 องค์ประกอบของผลิตภัณฑ์จากการสลายตัวขึ้นอยู่กับลักษณะของโลหะและระดับของการเกิดออกซิเดชัน อัตราการให้ความร้อน อุณหภูมิ องค์ประกอบของตัวกลางที่เป็นก๊าซ และเงื่อนไขอื่นๆ NH 4 NO 3 ระเบิดและเมื่อได้รับความร้อนอย่างรวดเร็วก็สามารถสลายตัวพร้อมกับการระเบิดได้ ในกรณีนี้ N 2, O 2 และ H 2 O จะเกิดขึ้น เมื่อได้รับความร้อนอย่างช้าๆ จะสลายตัวเป็น N 2 O และ H 2 O
ไอออน NO 3 อิสระในเฟสก๊าซมีโครงสร้างทางเรขาคณิตของสามเหลี่ยมด้านเท่าโดยมีอะตอม N อยู่ตรงกลาง มุมของ ONO ~ 120° และความยาวพันธะ N-O อยู่ที่ 0.121 นาโนเมตร ในไนเตรตที่เป็นผลึกและก๊าซ ไอออน NO 3 ยังคงรูปร่างและขนาดเป็นหลัก ซึ่งเป็นตัวกำหนดพื้นที่และโครงสร้างของไนเตรต NO 3 - ไอออนสามารถทำหน้าที่เป็นลิแกนด์แบบโมโน, ไบ, ตรีศูล หรือบริดจ์ ดังนั้นไนเตรตจึงมีลักษณะเฉพาะด้วยโครงสร้างผลึกหลายประเภท
โลหะทรานซิชันในสถานะออกซิเดชันสูงเนื่องจากสเตอริก แอนไฮดรัสไนเตรตไม่สามารถก่อปัญหาใดๆ ได้ และมีลักษณะพิเศษคือออกโซไนเตรต เช่น UO 2 (NO 3) 2, NbO(NO 3) 3 ไนเตรตก่อให้เกิดเกลือเชิงซ้อนและเชิงซ้อนจำนวนมากโดยมีไอออน NO 3 ในทรงกลมภายใน ในสื่อที่เป็นน้ำ ซึ่งเป็นผลมาจากไฮโดรไลซิส แคตไอออนของโลหะทรานซิชันจะเกิดเป็นไฮดรอกโซไนเตรต (ไนเตรตพื้นฐาน) ขององค์ประกอบที่แปรผันได้ ซึ่งสามารถแยกได้ในสถานะของแข็งเช่นกัน
ไนเตรตแบบไฮเดรตแตกต่างจากไนเตรตแบบแอนไฮดรัสตรงที่ในโครงสร้างผลึก ไอออนของโลหะโดยส่วนใหญ่แล้วจะเกี่ยวข้องกับโมเลกุลของน้ำมากกว่าไอออน NO 3 ดังนั้น จึงละลายได้ในน้ำได้ดีกว่าแอนไฮดรัสไนเตรต แต่ละลายได้น้อยกว่าในตัวทำละลายอินทรีย์ พวกมันเป็นตัวออกซิไดซ์ที่อ่อนกว่า และละลายอย่างไม่สอดคล้องกันในน้ำของการตกผลึกในช่วง 25-100°C เมื่อไนเตรตไฮเดรตถูกให้ความร้อน ตามกฎแล้วจะไม่เกิดไนเตรตปราศจากน้ำ แต่เทอร์โมไลซิสเกิดขึ้นกับการก่อตัวของไฮดรอกโซไนเตรต จากนั้นออกโซไนเตรตและออกไซด์ของโลหะ
ในคุณสมบัติทางเคมีหลายประการ ไนเตรตมีความคล้ายคลึงกับเกลืออนินทรีย์อื่นๆ คุณลักษณะเฉพาะของไนเตรตเกิดจากการละลายในน้ำได้สูงมาก มีความเสถียรทางความร้อนต่ำ และความสามารถในการออกซิไดซ์สารประกอบอินทรีย์และอนินทรีย์ เมื่อไนเตรตลดลงส่วนผสมของผลิตภัณฑ์ที่มีไนโตรเจน NO 2, NO, N 2 O, N 2 หรือ NH 3 จะเกิดขึ้นโดยมีความเด่นของหนึ่งในนั้นขึ้นอยู่กับประเภทของสารรีดิวซ์อุณหภูมิปฏิกิริยาของสิ่งแวดล้อม และปัจจัยอื่นๆ
วิธีการทางอุตสาหกรรมในการผลิตไนเตรตขึ้นอยู่กับการดูดซึมของ NH 3 โดยสารละลายของ HNO 3 (สำหรับ NH 4 NO 3) หรือการดูดซับก๊าซไนตรัส (NO + NO 2) ด้วยสารละลายของอัลคาลิสหรือคาร์บอเนต (สำหรับไนเตรตโลหะอัลคาไล Ca, Mg, Ba) รวมถึงปฏิกิริยาการแลกเปลี่ยนต่างๆ ของเกลือโลหะกับ HNO 3 หรือไนเตรตโลหะอัลคาไล ในห้องปฏิบัติการเพื่อรับไนเตรตไร้น้ำจะใช้ปฏิกิริยาของโลหะทรานซิชันหรือสารประกอบกับของเหลว N 2 O 4 และของผสมกับตัวทำละลายอินทรีย์หรือปฏิกิริยากับ N 2 O 5
ไนเตรต Na, K (โซเดียมและโพแทสเซียมไนเตรต) พบได้ในรูปของตะกอนตามธรรมชาติ
ไนเตรตถูกใช้ในหลายอุตสาหกรรม แอมโมเนียมไนไตรท์ (แอมโมเนียมไนเตรต) เป็นปุ๋ยที่มีไนโตรเจนหลัก โลหะอัลคาไลไนเตรตและ Ca ก็ใช้เป็นปุ๋ยเช่นกัน ไนเตรตเป็นส่วนประกอบของเชื้อเพลิงจรวด องค์ประกอบดอกไม้เพลิง สารละลายกัดสำหรับการย้อมผ้า ใช้สำหรับการชุบโลหะ การถนอมอาหาร เป็นยา และการผลิตโลหะออกไซด์
ไนเตรตเป็นพิษ ทำให้เกิดอาการบวมน้ำที่ปอด ไอ อาเจียน หลอดเลือดหัวใจล้มเหลวเฉียบพลัน ฯลฯ ปริมาณไนเตรตที่อันตรายถึงชีวิตสำหรับมนุษย์คือ 8-15 กรัม ปริมาณที่อนุญาตต่อวันคือ 5 มก./กก. สำหรับผลรวมของไนเตรต Na, K, Ca, NH3 MPC: ในน้ำ 45 มก./ลิตร ในดิน 130 มก./กก. (ระดับอันตราย 3) ในผักและผลไม้ (มก./กก.) - มันฝรั่ง 250, กะหล่ำปลีขาวตอนปลาย 500, แครอทตอนปลาย 250, หัวบีท 1400, หัวหอม 80, บวบ 400, แตง 90, แตงโม, องุ่น, แอปเปิ้ล, ลูกแพร์ 60 การไม่ปฏิบัติตามคำแนะนำทางการเกษตร การใช้ปุ๋ยมากเกินไปจะทำให้ปริมาณไนเตรตในผลิตภัณฑ์ทางการเกษตรเพิ่มขึ้นอย่างรวดเร็ว การไหลบ่าของพื้นผิวจาก ทุ่งนา (40-5500 มก./ลิตร) น้ำบาดาล
5. ไนไตรต์ เกลือของกรดไนตรัส HNO 2 ไนไตรต์ของโลหะอัลคาไลและแอมโมเนียมถูกใช้เป็นหลัก โดยมีธาตุอัลคาไลน์เอิร์ธและไนไตรต์น้อยกว่า ง- โลหะ Pb และ Ag มีเพียงข้อมูลที่ไม่เป็นชิ้นเป็นอันเกี่ยวกับไนไตรต์ของโลหะอื่น ๆ
โลหะไนไตรต์ในสถานะออกซิเดชัน +2 จะเกิดผลึกไฮเดรตโดยมีโมเลกุลน้ำหนึ่ง สอง หรือสี่โมเลกุล ไนไตรต์เกิดเป็นเกลือสองเท่าและสามชนิด เช่น CsNO 2 AgNO 2 หรือ Ba(NO 2) 2 Ni(NO 2) 2 2KNO 2 รวมถึงสารประกอบเชิงซ้อน เช่น Na 3
โครงสร้างผลึกเป็นที่รู้จักว่ามีไนไตรต์ปราศจากน้ำเพียงไม่กี่ตัวเท่านั้น ไอออน NO 2 มีโครงสร้างที่ไม่เป็นเชิงเส้น มุม ONO 115°, ความยาวพันธะ H-O 0.115 นาโนเมตร; ประเภทของพันธะ M-NO 2 คือไอออนิกโควาเลนต์
ไนไตรต์ K, Na, Ba ละลายได้ดีในน้ำ, ไนไตรต์ Ag, Hg, Cu ละลายได้ไม่ดี เมื่ออุณหภูมิเพิ่มขึ้น ความสามารถในการละลายของไนไตรต์จะเพิ่มขึ้น ไนไตรต์เกือบทั้งหมดละลายได้ไม่ดีในแอลกอฮอล์ อีเทอร์ และตัวทำละลายที่มีขั้วต่ำ
ไนไตรต์ไม่เสถียรทางความร้อน มีเพียงไนไตรต์ของโลหะอัลคาไลเท่านั้นที่ละลายโดยไม่สลายตัว ไนไตรต์ของโลหะอื่น ๆ จะสลายตัวที่อุณหภูมิ 25-300 °C กลไกการสลายตัวของไนไตรท์มีความซับซ้อนและรวมถึงปฏิกิริยาต่อเนื่องแบบขนานจำนวนหนึ่ง ผลิตภัณฑ์จากการสลายตัวของก๊าซหลักคือ NO, NO 2, N 2 และ O 2, ของแข็ง - โลหะออกไซด์หรือโลหะธาตุ การปล่อยก๊าซจำนวนมากทำให้เกิดการสลายตัวแบบระเบิดของไนไตรต์บางชนิด เช่น NH 4 NO 2 ซึ่งสลายตัวเป็น N 2 และ H 2 O
คุณลักษณะเฉพาะของไนไตรต์สัมพันธ์กับความไม่เสถียรทางความร้อนและความสามารถของไนไตรต์ไอออนในการเป็นทั้งตัวออกซิไดซ์และตัวรีดิวซ์ ขึ้นอยู่กับสภาพแวดล้อมและลักษณะของรีเอเจนต์ ในสภาพแวดล้อมที่เป็นกลาง ไนไตรต์มักจะลดลงเหลือ NO แต่ในสภาพแวดล้อมที่เป็นกรด ไนไตรต์จะถูกออกซิไดซ์เป็นไนเตรต ออกซิเจนและ CO 2 ไม่มีปฏิกิริยากับไนไตรต์ที่เป็นของแข็งและสารละลายที่เป็นน้ำ ไนไตรต์ส่งเสริมการสลายตัวของสารอินทรีย์ที่มีไนโตรเจน โดยเฉพาะเอมีน เอไมด์ ฯลฯ ด้วยเฮไลด์อินทรีย์ RXH ทำปฏิกิริยากับทั้งไนไตรต์ RONO และสารประกอบไนโตร RNO 2
การผลิตไนไตรต์ทางอุตสาหกรรมขึ้นอยู่กับการดูดซับก๊าซไนตรัส (ส่วนผสมของ NO + NO 2) กับสารละลายของ Na 2 CO 3 หรือ NaOH พร้อมการตกผลึกตามลำดับของ NaNO 2 ไนไตรต์ของโลหะอื่น ๆ ได้มาจากอุตสาหกรรมและห้องปฏิบัติการโดยปฏิกิริยาการแลกเปลี่ยนของเกลือโลหะกับ NaNO 2 หรือโดยการลดไนเตรตของโลหะเหล่านี้
ไนไตรต์ใช้สำหรับการสังเคราะห์สีย้อมเอโซในการผลิตคาโปรแลคตัม ใช้เป็นสารออกซิไดซ์และตัวรีดิวซ์ในอุตสาหกรรมยาง สิ่งทอ และงานโลหะ เป็นสารกันบูดในอาหาร ไนไตรต์ เช่น NaNO 2 และ KNO 2 เป็นพิษ ทำให้ปวดศีรษะ อาเจียน หายใจลำบาก เป็นต้น เมื่อ NaNO 2 ถูกวางยาพิษ เมทฮีโมโกลบินจะเกิดขึ้นในเลือด และเยื่อหุ้มเซลล์เม็ดเลือดแดงจะถูกทำลาย เป็นไปได้ที่จะสร้างไนโตรซามีนจาก NaNO 2 และเอมีนโดยตรงในทางเดินอาหาร
6. ซัลเฟต เกลือของกรดซัลฟิวริก รู้จักซัลเฟตปานกลางที่มี SO 4 2- แอนไอออนหรือไฮโดรซัลเฟตโดยมี HSO 4 - แอนไอออนพื้นฐานที่ประกอบด้วยพร้อมกับ SO 4 2- แอนไอออนกลุ่ม OH เช่น Zn 2 (OH) 2 SO 4 นอกจากนี้ยังมีซัลเฟตสองชั้นที่มีแคตไอออนต่างกันสองตัว ซึ่งรวมถึงซัลเฟตสองกลุ่มใหญ่ - สารส้ม , เช่นเดียวกับ shenites M 2 E (SO 4) 2 6H 2 O , โดยที่ M คือไอออนบวกที่มีประจุเดี่ยว E คือ Mg, Zn และไอออนบวกที่มีประจุสองเท่าอื่นๆ รู้จักซัลเฟตสามตัว K 2 SO 4 MgSO 4 2CaSO 4 · 2H 2 O (แร่โพลีฮาไลต์), ซัลเฟตพื้นฐานสองเท่าเช่นแร่ธาตุของกลุ่มอะลูไนต์และจาโรไซต์ M 2 SO 4 Al 2 (SO 4) 3 4Al (OH 3 และ M 2 SO 4 Fe 2 (SO 4) 3 4Fe(OH) 3 โดยที่ M เป็นไอออนบวกที่มีประจุเดี่ยว ซัลเฟตอาจเป็นส่วนหนึ่งของเกลือผสม เช่น 2Na 2 SO 4 Na 2 CO 3 (แร่เบอร์ไคต์), MgSO 4 KCl 3H 2 O (ไคไนต์) .
ซัลเฟตเป็นสารที่เป็นผลึก ปานกลางและเป็นกรดในกรณีส่วนใหญ่ ละลายได้สูงในน้ำ ซัลเฟตของแคลเซียม สตรอนเทียม ตะกั่วและอื่นๆ บางชนิดละลายได้เล็กน้อย BaSO 4 และ RaSO 4 แทบไม่ละลายเลย ซัลเฟตพื้นฐานมักจะละลายได้ไม่ดีหรือไม่ละลายในทางปฏิบัติ หรือถูกไฮโดรไลซ์ด้วยน้ำ จากสารละลายที่เป็นน้ำ ซัลเฟตสามารถตกผลึกในรูปของผลึกไฮเดรต ผลึกไฮเดรตของโลหะหนักบางชนิดเรียกว่ากรดกำมะถัน คอปเปอร์ซัลเฟต CuSO 4 · 5H 2 O, เหล็กซัลเฟต FeSO 4 · 7H 2 O
ซัลเฟตโลหะอัลคาไลปานกลางมีความเสถียรทางความร้อนในขณะที่กรดซัลเฟตสลายตัวเมื่อถูกความร้อนกลายเป็นไพโรซัลเฟต: 2KHSO 4 = H 2 O + K 2 S 2 O 7 ตามกฎแล้วซัลเฟตปานกลางของโลหะอื่น ๆ รวมถึงซัลเฟตพื้นฐานเมื่อถูกความร้อนถึงอุณหภูมิสูงพอสมควรจะสลายตัวด้วยการก่อตัวของโลหะออกไซด์และการปล่อย SO 3
ซัลเฟตมีการกระจายอย่างกว้างขวางในธรรมชาติ พบได้ในรูปของแร่ธาตุ เช่น ยิปซั่ม CaSO 4 H 2 O, มิราบิไลต์ Na 2 SO 4 · 10H 2 O และยังเป็นส่วนหนึ่งของน้ำทะเลและแม่น้ำด้วย
ซัลเฟตจำนวนมากสามารถได้รับจากปฏิกิริยาของ H 2 SO 4 กับโลหะ, ออกไซด์และไฮดรอกไซด์ของพวกมันรวมถึงการสลายตัวของเกลือของกรดระเหยกับกรดซัลฟิวริก
ซัลเฟตอนินทรีย์มีการใช้กันอย่างแพร่หลาย ตัวอย่างเช่น แอมโมเนียมซัลเฟตเป็นปุ๋ยไนโตรเจน โซเดียมซัลเฟตใช้ในอุตสาหกรรมแก้ว อุตสาหกรรมกระดาษ การผลิตวิสโคส เป็นต้น แร่ธาตุซัลเฟตธรรมชาติเป็นวัตถุดิบสำหรับการผลิตทางอุตสาหกรรมของสารประกอบของโลหะต่างๆ วัสดุก่อสร้าง ฯลฯ
7.ซัลไฟต์เกลือของกรดซัลฟูรัส H 2 SO 3 . มีซัลไฟต์ขนาดกลางที่มีไอออน SO 3 2- และกรด (ไฮโดรซัลไฟต์) โดยมีไอออน HSO 3 - . ซัลไฟต์ปานกลางเป็นสารที่เป็นผลึก แอมโมเนียมและโลหะอัลคาไลซัลไฟต์ละลายในน้ำได้สูง ความสามารถในการละลาย (กรัมใน 100 กรัม): (NH 4) 2 SO 3 40.0 (13 ° C), K 2 SO 3 106.7 (20 ° C) ไฮโดรซัลไฟต์เกิดขึ้นในสารละลายที่เป็นน้ำ ซัลไฟต์ของอัลคาไลน์เอิร์ธและโลหะอื่น ๆ บางชนิดแทบไม่ละลายในน้ำ ความสามารถในการละลายของ MgSO 3 1 กรัม ใน 100 กรัม (40°C) คริสตัลไฮเดรตที่รู้จัก (NH 4) 2 SO 3 H 2 O, Na 2 SO 3 7H 2 O, K 2 SO 3 2H 2 O, MgSO 3 6H 2 O เป็นต้น
แอนไฮดรัสซัลไฟต์เมื่อถูกความร้อนโดยไม่ต้องเข้าถึงอากาศในภาชนะที่ปิดสนิทจะถูกแบ่งออกเป็นซัลไฟด์และซัลเฟตอย่างไม่เป็นสัดส่วนเมื่อถูกความร้อนด้วยกระแส N 2 พวกมันจะสูญเสีย SO 2 และเมื่อถูกความร้อนในอากาศพวกมันจะถูกออกซิไดซ์เป็นซัลเฟตได้ง่าย ด้วย SO 2 ในสภาพแวดล้อมที่เป็นน้ำ ซัลไฟต์ขนาดกลางจะเกิดเป็นไฮโดรซัลไฟต์ ซัลไฟต์เป็นสารรีดิวซ์ที่ค่อนข้างแรงโดยจะถูกออกซิไดซ์ในสารละลายที่มีคลอรีน, โบรมีน, H 2 O 2 ฯลฯ ไปจนถึงซัลเฟต พวกมันสลายตัวด้วยกรดแก่ (เช่น HC1) โดยปล่อย SO 2
ผลึกไฮโดรซัลไฟต์เป็นที่รู้จักสำหรับ K, Rb, Cs, NH 4 + ซึ่งไม่เสถียร ไฮโดรซัลไฟต์ที่เหลือจะมีอยู่ในสารละลายที่เป็นน้ำเท่านั้น ความหนาแน่นของ NH 4 HSO 3 2.03 g/cm 3 ; ความสามารถในการละลายในน้ำ (กรัมใน 100 กรัม): NH 4 HSO 3 71.8 (0 ° C), KHSO 3 49 (20 ° C)
เมื่อผลึกไฮโดรซัลไฟต์ Na หรือ K ถูกให้ความร้อนหรือเมื่อสารละลายเยื่อกระดาษอิ่มตัวด้วย SO 2 M 2 SO 3 จะเกิดไพโรซัลไฟต์ (ล้าสมัย - เมตาไบซัลไฟต์) M 2 S 2 O 5 - เกลือของกรดไพโรซัลฟิวริกอิสระที่ไม่รู้จัก H 2 S 2 โอ้ 5; คริสตัลไม่เสถียร ความหนาแน่น (g/cm3): Na 2 S 2 O 5 1.48, K 2 S 2 O 5 2.34; สูงกว่า ~ 160 °C พวกมันสลายตัวเมื่อปล่อย SO 2 ละลายในน้ำ (โดยสลายตัวเป็น HSO 3 -) ความสามารถในการละลาย (กรัมใน 100 กรัม): นา 2 S 2 O 5 64.4, K 2 S 2 O 5 44.7; รูปแบบไฮเดรต Na 2 S 2 O 5 7H 2 O และ ZK 2 S 2 O 5 2H 2 O; สารรีดิวซ์
ซัลไฟต์โลหะอัลคาไลปานกลางเตรียมโดยทำปฏิกิริยาสารละลายน้ำของ M 2 CO 3 (หรือ MOH) กับ SO 2 และ MSO 3 โดยผ่าน SO 2 ผ่านสารแขวนลอยในน้ำของ MCO 3 ส่วนใหญ่จะใช้ SO 2 จากก๊าซไอเสียจากการผลิตกรดซัลฟิวริกสัมผัส ซัลไฟต์ใช้ในการฟอกสี การย้อม และการพิมพ์ผ้า เส้นใย หนังเพื่อการอนุรักษ์เมล็ดพืช อาหารสีเขียว ขยะอุตสาหกรรมอาหารสัตว์ (NaHSO 3,
นา 2 ส 2 โอ 5) CaSO 3 และ Ca(HSO 3) 2 เป็นสารฆ่าเชื้อในอุตสาหกรรมการผลิตไวน์และน้ำตาล NaHSO 3, MgSO 3, NH 4 HSO 3 - ส่วนประกอบของสุราซัลไฟต์ระหว่างการผลิตเยื่อกระดาษ (NH 4) ตัวดูดซับ 2 SO 3 - SO 2; NaHSO 3 เป็นตัวดูดซับ H 2 S จากก๊าซเสียทางอุตสาหกรรมซึ่งเป็นตัวรีดิวซ์ในการผลิตสีย้อมกำมะถัน K 2 S 2 O 5 - ส่วนประกอบของสารยึดเกาะที่เป็นกรดในการถ่ายภาพสารต้านอนุมูลอิสระและน้ำยาฆ่าเชื้อ
วิธีการแยกสารผสม
การกรอง การแยกระบบที่ต่างกันของระบบที่ต่างกัน ของเหลว - อนุภาคของแข็ง (สารแขวนลอย) และก๊าซ - อนุภาคของแข็งโดยใช้พาร์ติชั่นตัวกรองที่มีรูพรุน (FP) ซึ่งช่วยให้ของเหลวหรือก๊าซไหลผ่านได้ แต่ยังคงรักษาอนุภาคของแข็งไว้ แรงผลักดันของกระบวนการคือความแตกต่างของความดันทั้งสองด้านของการเปลี่ยนเฟส
เมื่อแยกสารแขวนลอย อนุภาคของแข็งมักจะก่อตัวเป็นชั้นตะกอนเปียกบน FP ซึ่งหากจำเป็น จะถูกล้างด้วยน้ำหรือของเหลวอื่น ๆ และยังทำให้แห้งโดยการเป่าลมหรือก๊าซอื่น ๆ ผ่านเข้าไปด้วย การกรองจะดำเนินการที่ความแตกต่างของแรงดันคงที่หรือที่ความเร็วกระบวนการคงที่ ว(ปริมาณของการกรองในหน่วย m 3 ที่ผ่าน 1 m 2 ของพื้นผิว FP ต่อหน่วยเวลา) ที่ความแตกต่างของแรงดันคงที่ ระบบกันสะเทือนจะถูกส่งไปยังตัวกรองภายใต้สุญญากาศหรือแรงดันส่วนเกิน รวมถึงโดยปั๊มลูกสูบ เมื่อใช้ปั๊มแบบแรงเหวี่ยง ความแตกต่างของแรงดันจะเพิ่มขึ้นและความเร็วของกระบวนการลดลง
การกรองหลายประเภทมีความโดดเด่นขึ้นอยู่กับความเข้มข้นของสารแขวนลอย ที่ความเข้มข้นมากกว่า 1% การกรองจะเกิดขึ้นพร้อมกับการก่อตัวของตะกอนและที่ความเข้มข้นน้อยกว่า 0.1% โดยมีการอุดตันของรูขุมขนของ FP (การทำให้ของเหลวใส) หากชั้นตะกอนที่มีความหนาแน่นเพียงพอไม่ก่อตัวบน FP และอนุภาคของแข็งเข้าไปในตัวกรอง ให้กรองโดยใช้วัสดุเสริมที่กระจายอย่างประณีต (ดินเบา, เพอร์ไลต์) ซึ่งก่อนหน้านี้นำไปใช้กับ FP หรือเพิ่มเข้าไปในสารแขวนลอย ที่ความเข้มข้นเริ่มต้นน้อยกว่า 10% สามารถแยกสารแขวนลอยบางส่วนและทำให้สารแขวนลอยหนาขึ้นได้
มีตัวกรองแบบต่อเนื่องและเป็นระยะ ในระยะหลัง ขั้นตอนหลักของงานคือการกรอง ล้างตะกอน การแยกน้ำออก และการขนถ่ายออก ในกรณีนี้ การปรับให้เหมาะสมตามเกณฑ์การผลิตสูงสุดและต้นทุนต่ำสุดจะถูกนำมาใช้ หากไม่ได้ทำการล้างและแยกน้ำออก และสามารถละเลยความต้านทานไฮดรอลิกของพาร์ติชันได้ ผลผลิตสูงสุดจะเกิดขึ้นได้เมื่อเวลาในการกรองเท่ากับระยะเวลาของการดำเนินการเสริม
FP ที่ยืดหยุ่นได้ซึ่งทำจากผ้าฝ้าย ขนสัตว์ ผ้าใยสังเคราะห์ และใยแก้วสามารถใช้ได้ เช่นเดียวกับ FP ที่ไม่ถักทอที่ทำจากเส้นใยธรรมชาติและเส้นใยสังเคราะห์และเส้นใยที่ไม่ยืดหยุ่น เช่น เซรามิก เซอร์เม็ท และโฟม ทิศทางการเคลื่อนที่ของตัวกรองและการกระทำของแรงโน้มถ่วงสามารถตรงกันข้าม ตรงกัน หรือตั้งฉากกัน
การออกแบบตัวกรองมีหลากหลาย หนึ่งในสิ่งที่พบได้บ่อยที่สุดคือตัวกรองสูญญากาศแบบดรัมหมุน (ซม.รูป) ของการกระทำต่อเนื่องซึ่งทิศทางการเคลื่อนที่ของตัวกรองและการกระทำของแรงโน้มถ่วงอยู่ตรงข้ามกัน ส่วนอุปกรณ์กระจายจะเชื่อมต่อโซน I และ II กับแหล่งจ่ายสุญญากาศ และโซน III และ IV กับแหล่งอากาศอัด สารกรองและน้ำยาล้างจานจากโซน I และ II จะเข้าสู่เครื่องรับแยกกัน เครื่องกรองแบบตั้งเวลาอัตโนมัติพร้อมช่องแนวนอน ผ้ากรองในรูปแบบของสายพานแบบไม่มีที่สิ้นสุด และเยื่อยืดหยุ่นสำหรับการแยกน้ำออกจากตะกอนโดยการกดก็แพร่หลายมากขึ้นเช่นกัน โดยดำเนินการสลับการทำงานของห้องเติมด้วยระบบกันสะเทือน การกรอง การล้างและการแยกน้ำออกจากตะกอน การตัดการเชื่อมต่อห้องที่อยู่ติดกัน และการกำจัดตะกอน